În experimentele qPCR, proiectarea primerului este, de asemenea, o legătură foarte importantă.Dacă primerii sunt potriviți sau nu este strâns legat de faptul că eficiența de amplificare atinge standardul, dacă produsele amplificate sunt specifice și dacă rezultatele experimentale sunt disponibile.
Deci, cum să îmbunătățiți specificitatea primerului qPCR?Eficiență mare de amplificare?
Astăzi, vă vom conduce să proiectați primeri qPCR împreună și să lăsăm proiectarea primerului qPCR să devină o abilitate eficientă în experimente.
Când proiectați primeri qPCR, de obicei, acordați atenție următoarelor puncte: primerii ar trebui să fie proiectați pe introni cât mai mult posibil, lungimea produsului ar trebui să fie de 100-300 bp, valoarea Tm ar trebui să fie cât mai aproape posibil de 60°C, iar primerii din amonte și din aval ar trebui să fie cât mai aproape posibil, iar sfârșitul primerului ar trebui să fie G sau C etc. așteptați.
1. Proiectarea primerilor care acoperă introni
La proiectarea primerilor qPCR, alegerea primerilor proiectați pe introni poate preveni amplificarea șablonului de ADNg, iar produsele sunt toate derivate din amplificarea ADNc, eliminând astfel influența contaminării cu ADNg.
2. Lungimea grundului
Lungimea primerului este în general între 18-30 nt, iar lungimea produsului de amplificare trebuie controlată între 100-300 bp cât mai mult posibil.
Dacă primerul este prea scurt, va duce la o amplificare nespecifică, iar dacă este prea lung, va forma cu ușurință o structură secundară (cum ar fi structura ac de păr).Dacă produsul de amplificare este prea lung, nu este potrivit pentru reacția polimerazei, ceea ce va afecta eficiența amplificării PCR.
3. Conținutul GC și valoarea Tm
Conținutul de GC al primerilor trebuie controlat între 40% și 60%.Dacă este prea mare sau prea scăzută, nu este favorabilă inițierii reacției.Conținutul de GC al primerului direct și invers ar trebui să fie aproape de același pentru a obține aceeași valoare Tm și temperatură de recoacere.
Valoarea Tm ar trebui să fie între 55-65°C pe cât posibil, în general în jur de 60°C, iar valoarea Tm din amonte și aval ar trebui să fie cât mai apropiată posibil, de preferință nu mai mult de 4°C.
4. Evitați să selectați A la capătul 3′ al grundului
Când capătul 3′ al primerului este nepotrivit, există diferențe mari în eficiența sintezei diferitelor baze.Când ultima bază este A, poate iniția și sinteza lanțului chiar și în cazul nepotrivirii, iar când ultima bază este T Când , eficiența inducției nepotrivirii este mult redusă.Prin urmare, încercați să evitați să alegeți A la capătul 3′ al grundului și este mai bine să alegeți T.
Dacă este un primer de sondă, capătul 5′ al sondei nu poate fi G, deoarece chiar și atunci când o singură bază G este conectată la grupul reporter fluorescent FAM, G poate stinge și semnalul fluorescent emis de grupul FAM, rezultând rezultate fals negative.Apărea.
5. Distribuția de bază
Distribuția celor patru baze în primer este de preferință aleatorie, evitând mai mult de 3 G sau C consecutive la capătul 3′ și mai mult de 3 consecutive.G sau C sunt ușor de generat pereche în regiunea secvenței bogate în GC.
6. Regiunea de proiectare a amorsei ar trebui să evite structurile secundare complexe.
Structura secundară formată din catenul unic al produsului de amplificare va afecta progresul lin al PCR.Prevăzând în prealabil dacă există o structură secundară în secvența țintă, încercați să evitați această regiune în proiectarea primerilor.
7. Primerii înșiși și între primeri ar trebui să încerce să evite bazele complementare consecutive.
Nu poate exista o complementaritate consecutivă de 4 baze între primer și primer.Primerul în sine nu ar trebui să aibă o secvență complementară, altfel se va plia pentru a forma o structură în ac de păr, care va afecta combinația de recoacere a primerului și a șablonului.
Secvențe complementare nu pot exista între primerii din amonte și din aval.Complementaritatea între primeri va produce dimeri de primer, care vor reduce eficiența PCR și chiar vor afecta acuratețea cantitativă.Dacă structurile primer-dimer și ac de păr sunt inevitabile, valoarea △G nu trebuie să fie prea mare (ar trebui să fie mai mică de 4,5 kcal/mol).
8. Primerii amplifică produsul specific țintă.
Scopul final al detectării qPCR este de a înțelege abundența genei țintă.Dacă apare o amplificare nespecifică, cuantificarea va fi inexactă.Prin urmare, după ce primerii sunt proiectați, aceștia trebuie testați de BLAST, iar specificitatea produselor este comparată în baza de date de secvențe.
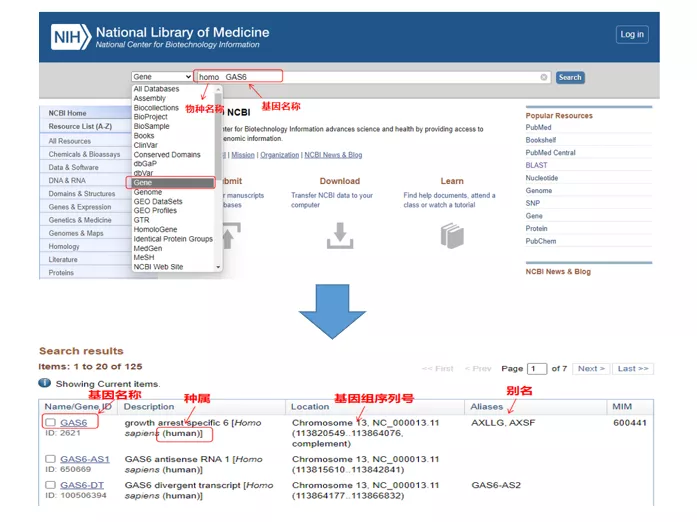
În continuare, luăm gena umană GAS6 (Growth stop specific 6) ca exemplu pentru a proiecta primeri qPCR.
01 gena de interogare
Homo GAS6prin NCBI .Aici, ar trebui să acordăm atenție comparării denumirii genei și speciilor pentru a ne asigura că sunt consecvente.
 02 Găsiți secvența genelor
02 Găsiți secvența genelor
(1) Dacă secvența țintă este ADN genomic, selectați primul, care este secvența ADN genomic a genei.
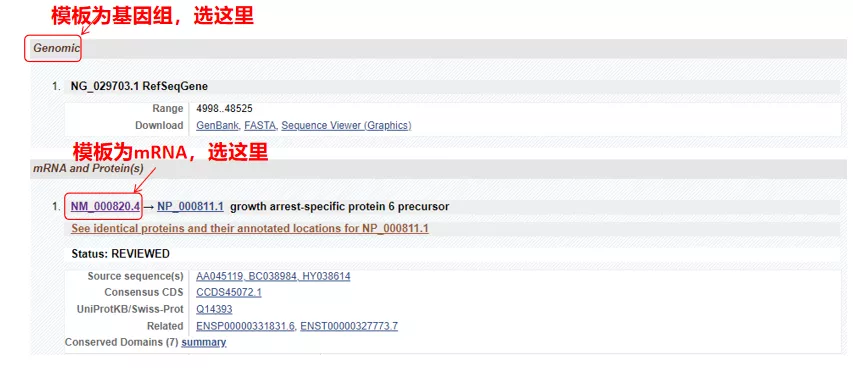 (2) Dacă secvența țintă este ARNm, selectați a doua.După introducere, faceți clic pe „CDS” în tabelul de mai jos.Secvența de fundal maro este secvența de codificare a genei.
(2) Dacă secvența țintă este ARNm, selectați a doua.După introducere, faceți clic pe „CDS” în tabelul de mai jos.Secvența de fundal maro este secvența de codificare a genei.
 03 Grunduri de proiectare
03 Grunduri de proiectare
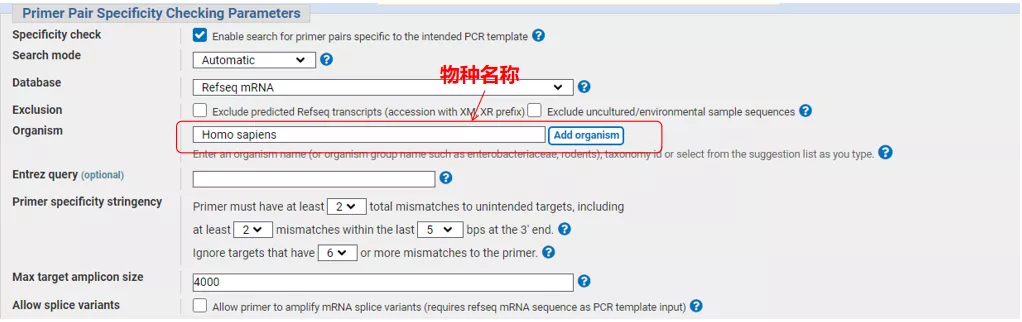
Intrați în interfața Primer-BLAST
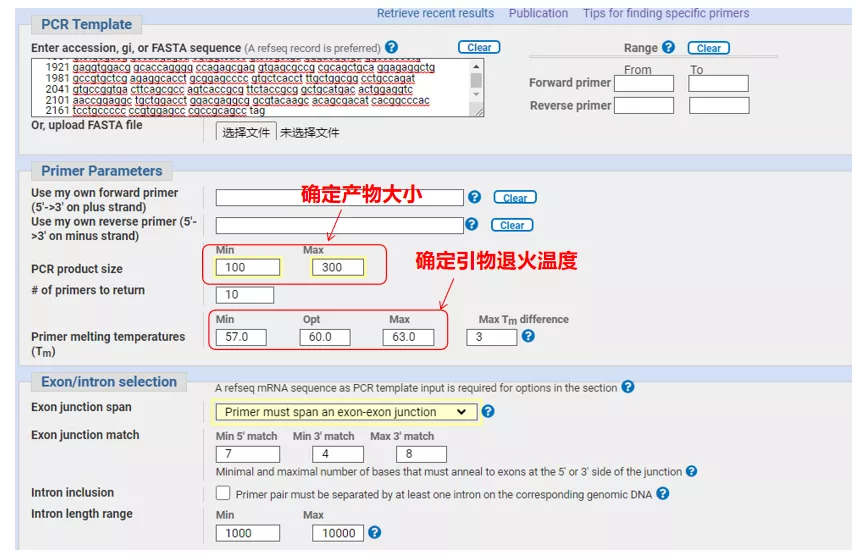
 Introduceți numărul secvenței genei sau secvența în format Fasta în stânga sus și completați parametrii relevanți.
Introduceți numărul secvenței genei sau secvența în format Fasta în stânga sus și completați parametrii relevanți.
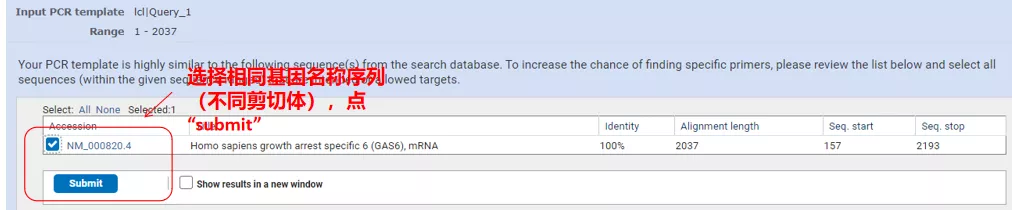
Faceți clic pe „Obțineți primeri” și va apărea NCBI pentru a vă spune că o astfel de selecție a parametrilor va fi amplificată la alte variante de îmbinare.Putem verifica diferitele variante de îmbinare și le putem trimite pentru a obține perechea de primer corespunzătoare (așa cum se arată în figura de mai jos).Acest proces poate dura zeci de secunde.
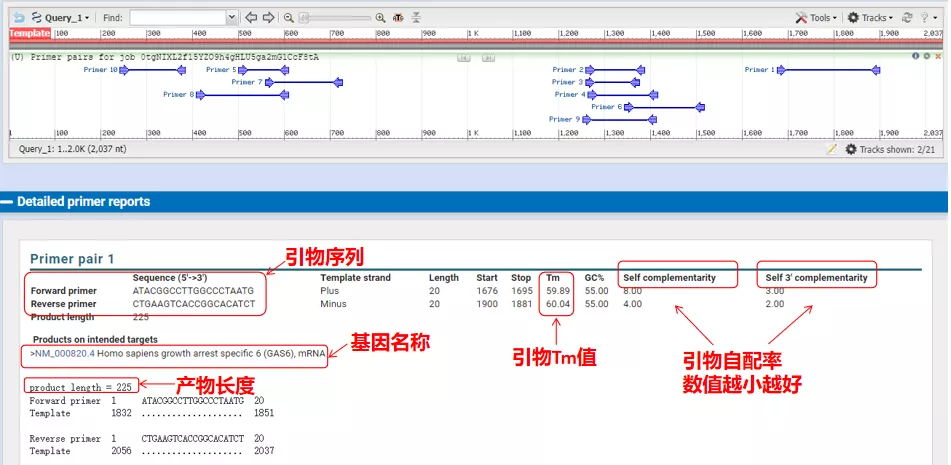 Temperaturile de recoacere ale acestor perechi de primeri sunt în jur de 60°C.În funcție de scopul experimentului, alegeți primeri cu lungime moderată, specificitate bună și mai puțină autocomplementare a primerilor pentru experiment, iar rata de succes este destul de mare!
Temperaturile de recoacere ale acestor perechi de primeri sunt în jur de 60°C.În funcție de scopul experimentului, alegeți primeri cu lungime moderată, specificitate bună și mai puțină autocomplementare a primerilor pentru experiment, iar rata de succes este destul de mare!
04Verificarea specificității primerului
De fapt, pe lângă proiectarea amorselor, Primer-Blast poate evalua și amorsele pe care le-am proiectat noi înșine.Reveniți la pagina de proiectare a primerului, introduceți amorsele din amonte și din aval pe care le-am proiectat, iar alți parametri nu vor fi ajustați.După trimitere, puteți vedea dacă perechea de primeri există și pe alte gene.Dacă toate sunt afișate pe gena pe care vrem să o amplificăm, indicând faptul că specificul acestei perechi de primeri este mare!(De exemplu, acesta este singurul rezultat al interogării primer!)
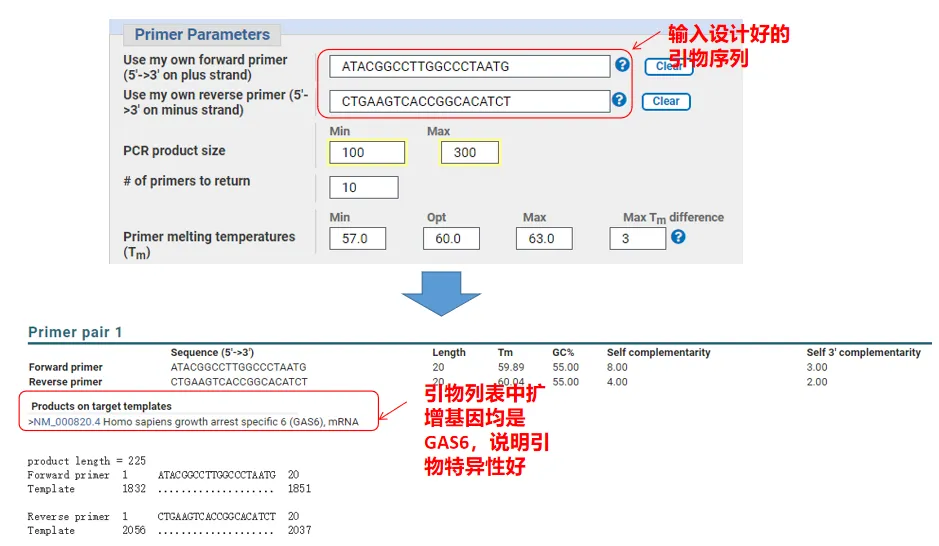
05 Judecata de calitate a amorsei
Ce fel de primer este primerul „perfect” care combină „eficiența de amplificare până la standard”, „caracteristicile produsului amplificat” și „rezultate experimentale de încredere”?
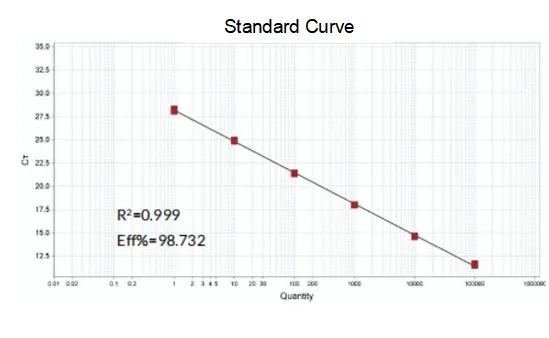 Eficienta de amplificare
Eficienta de amplificare
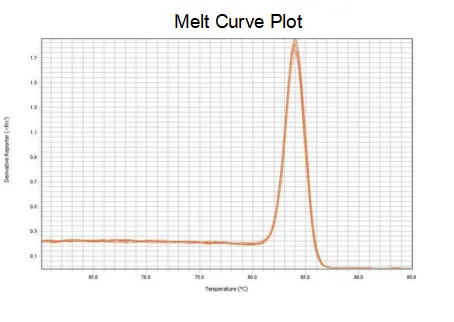 curba de topire
curba de topire
Eficiența de amplificare a primerilor ajunge la 90%-110%, ceea ce înseamnă că eficiența de amplificare este bună, iar curba de topire are un singur vârf și de obicei Tm>80°C, ceea ce înseamnă că specificitatea de amplificare este bună.
Produse asemanatoare:
Real Time PCR Easy–SYBR GREEN I
PCR în timp real Easy-Taqman
Ora postării: 10-feb-2023








