Tehnologia de diagnosticare moleculară utilizează metode de biologie moleculară pentru a detecta expresia și structura materialului genetic al corpului uman și diferiți agenți patogeni, astfel încât să se atingă scopul de a prezice și diagnostica boli.
În ultimii ani, odată cu modernizarea și iterarea tehnologiei de diagnostic molecular, aplicarea clinică a diagnosticului molecular a devenit din ce în ce mai extinsă și mai aprofundată, iar piața de diagnosticare moleculară a intrat într-o perioadă de dezvoltare rapidă.
Autorul rezumă tehnologiile comune de diagnostic molecular de pe piață și este împărțit în trei părți: prima parte prezintă tehnologia PCR, a doua parte introduce tehnologia de amplificare izotermă a acidului nucleic, iar a doua parte introduce tehnologia de secvențiere.
01
Partea I: Tehnologia PCR
Tehnologia PCR
PCR (reacția în lanț a polimerazei) este una dintre tehnologiile de amplificare a ADN in vitro, cu o istorie de peste 30 de ani.
Tehnologia PCR a fost lansată în 1983 de Kary Mullis din Cetus, SUA.Mullis a solicitat un brevet PCR în 1985 și a publicat prima lucrare academică PCR despre Știință în același an.Mullis a câștigat Premiul Nobel pentru Chimie în 1993.
Principiile de bază ale PCR
PCR poate amplifica fragmentele de ADN țintă de peste un milion de ori.Principiul este că sub cataliza ADN polimerazei, catena de ADN părinte este utilizată ca șablon, iar un primer specific este utilizat ca punct de plecare pentru extensie.Este replicat in vitro prin etape precum denaturarea, recoacere și extensie.Procesul ADN-ului catenei fiice complementar cu ADN-ul șablon al catenei părinte.
Procesul PCR standard este împărțit în trei etape:
1. Denaturare: Folosiți temperaturi ridicate pentru a separa catenele duble de ADN.Legăturile de hidrogen dintre duble catena ADN sunt rupte la temperaturi ridicate (93-98°C).
2. Recoacere: După ce ADN-ul dublu catenar este separat, temperatura este scăzută, astfel încât primerul să se poată lega de ADN-ul monocatenar.
3. Extensie: ADN polimeraza începe să sintetizeze catenele complementare de-a lungul catenelor de ADN de la primeri legați atunci când temperatura este scăzută.Când extinderea este finalizată, un ciclu este încheiat și numărul de fragmente de ADN se dublează.
Schimbând aceste trei etape de 25-35 de ori, numărul fragmentelor de ADN va crește exponențial.
Ingeniozitatea PCR este că diferiți primeri pot fi proiectați pentru diferite gene țintă, astfel încât fragmentele genei țintă să poată fi amplificate într-o perioadă scurtă de timp.
Până acum, PCR poate fi împărțită în trei categorii, și anume PCR obișnuită, PCR cantitativă fluorescentă și PCR digitală.
Prima generație de PCR obișnuit
Utilizați un instrument obișnuit de amplificare PCR pentru a amplifica gena țintă și apoi utilizați electroforeza pe gel de agaroză pentru a detecta produsul, se poate face doar analiză calitativă.
Principalele dezavantaje ale PCR de prima generație:
-Supus la amplificare nespecifică și la rezultate fals pozitive.
-Detecția durează mult și operațiunea este greoaie.
-Se pot face doar teste calitative.
PCR cantitativ cu fluorescență de a doua generație
PCR cantitativ cu fluorescență (PCR în timp real), cunoscut și sub numele de qPCR, este utilizat pentru a monitoriza acumularea de produse amplificate prin acumularea de semnale fluorescente prin adăugarea de sonde fluorescente care pot indica progresul sistemului de reacție și pentru a judeca rezultatele prin curba de fluorescență și poate fi cuantificată cu ajutorul valorii Cq și curbei standard.
Deoarece tehnologia qPCR este realizată într-un sistem închis, probabilitatea de contaminare este redusă, iar semnalul de fluorescență poate fi monitorizat pentru detectarea cantitativă, deci este cea mai utilizată în practica clinică și a devenit tehnologia dominantă în PCR.
Substanțele fluorescente utilizate în PCR cantitativ fluorescent în timp real pot fi împărțite în: sonde fluorescente TaqMan, balize moleculare și coloranți fluorescenți.
1) Sondă fluorescentă TaqMan:
În timpul amplificării PCR, se adaugă o sondă fluorescentă specifică în timp ce se adaugă o pereche de primeri.Sonda este o oligonucleotidă, iar cele două capete sunt marcate cu o grupare fluorescentă reporter și respectiv o grupare fluorescentă de extindere.
Când sonda este intactă, semnalul fluorescent emis de grupul raportor este absorbit de grupul de stingere;în timpul amplificării PCR, activitatea exonucleazei 5′-3′ a enzimei Taq scindează și degradează sonda, făcând grupul fluorescent reporter și stingerea Grupul fluorescent este separat, astfel încât sistemul de monitorizare a fluorescenței să poată primi semnalul de fluorescență, adică de fiecare dată când o catenă de ADN este amplificată, se formează un semnal fluorescent și se sincronizează complet cu formarea fluorescentă a fluorescenței. produsul PCR.
2) Coloranți fluorescenți SYBR:
În sistemul de reacție PCR, se adaugă un exces de colorant fluorescent SYBR.După ce colorantul fluorescent SYBR este încorporat nespecific în dublu catena ADN, emite un semnal fluorescent.Molecula de colorant SYBR care nu este încorporată în lanț nu va emite niciun semnal fluorescent, asigurând astfel semnalul fluorescent. Creșterea produselor PCR este complet sincronizată cu creșterea produselor PCR.SYBR se leagă doar de ADN-ul dublu catenar, astfel încât curba de topire poate fi utilizată pentru a determina dacă reacția PCR este specifică.
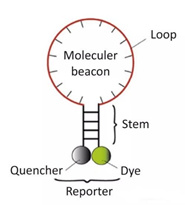
3) Balize moleculare
Este o sondă oligonucleotidă dublu marcată cu buclă de tulpină care formează o structură în ac de păr de aproximativ 8 baze la 5 și 3 capete.Secvențele de acid nucleic de la ambele capete sunt împerecheate complementar, determinând gruparea fluorescentă și gruparea de stingere să fie strânse.Aproape, nu va produce fluorescență.
După ce produsul PCR este generat, în timpul procesului de recoacere, partea de mijloc a farului molecular este asociată cu o secvență specifică de ADN, iar gena fluorescentă este separată de gena de stingere pentru a produce fluorescență.
Principalele dezavantaje ale PCR de a doua generație:
Sensibilitatea încă lipsește, iar detectarea exemplarelor cu copii mici nu este precisă.
Există o influență a valorii de fundal, iar rezultatul este susceptibil la interferență.
PCR digital de a treia generație
PCR digitală (DigitalPCR, dPCR, Dig-PCR) calculează numărul de copiere al secvenței țintă prin detectarea punctului final și poate efectua o detecție cantitativă absolută precisă fără a utiliza controale interne și curbe standard.
PCR digitală utilizează detecția punctului final și nu depinde de valoarea Ct (pragul ciclului), astfel încât reacția PCR digitală este mai puțin afectată de eficiența amplificării, iar toleranța la inhibitorii de reacție PCR este îmbunătățită, cu acuratețe și reproductibilitate ridicate.
Datorită caracteristicilor de înaltă sensibilitate și precizie ridicată, nu este ușor interferat de inhibitorii de reacție PCR și poate realiza o cuantificare absolută adevărată fără produse standard, care a devenit un punct fierbinte de cercetare și aplicare.
În funcție de diferitele forme ale unității de reacție, aceasta poate fi împărțită în trei tipuri: sisteme microfluidice, cip și picături.
Ora postării: Iul-08-2021