Prezentare generală
Identificarea rapidă a plantelor transgenice
Text/Tong Yucheng
Operațiune experimentală/Han Ying
Editor/Wen Youjun
Cuvinte/1600+
Timp de lectură recomandat/8-10 minute
Identificarea rapidă a plantelor transgenice
Ca nou venit în laborator, nu este o treabă bună să eliminați plantele pozitive dintr-o grămadă de plante cu o rată de conversie scăzută.În primul rând, ADN-ul trebuie extras dintr-un număr mare de probe una câte una, iar apoi genele străine vor fi detectate prin PCR.Cu toate acestea, rezultatele sunt adesea spații libere și benzi cu câteva elemente ocazional, dar este imposibil să se determine dacă există detectări ratate sau false..Este foarte neajutorat să înfrunți un astfel de proces și rezultate experimentale?Nu vă faceți griji, fratele vă învață cum să eliminați plantele pozitive transgenice ușor și precis.
Pasul 1: Proiectare amorse de detectare
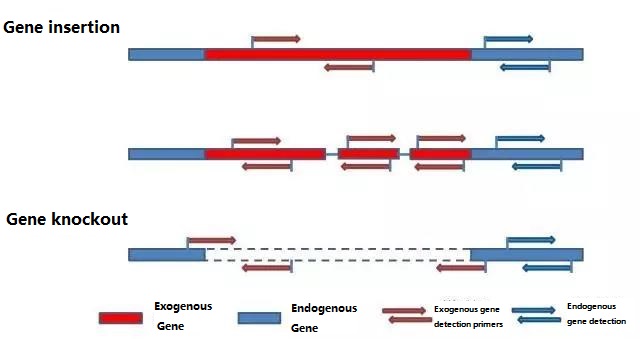
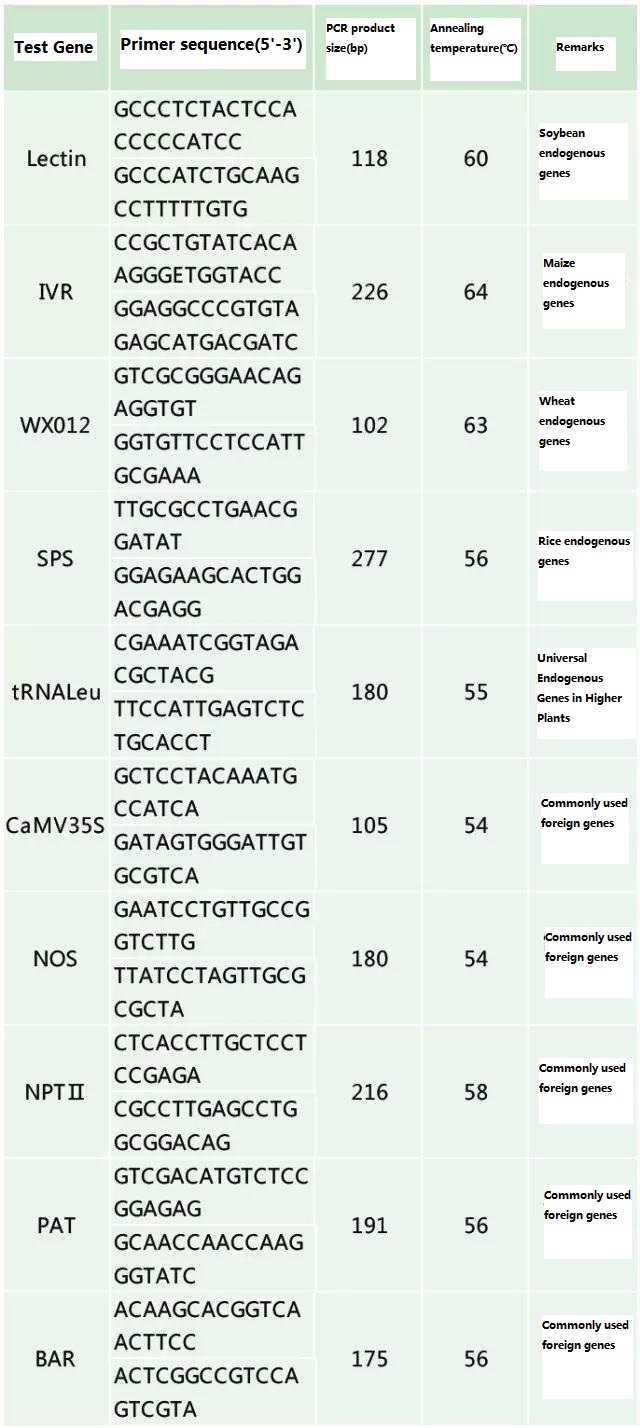
Determinați gena endogenă și gena exogenă care urmează să fie detectate în funcție de proba de testat și selectați o secvență reprezentativă de 100-500 pb în genă pentru proiectarea primerului.Primerii buni pot asigura acuratețea rezultatelor de detecție și pot scurta timpul de detecție (vezi anexa pentru primerii de detecție utilizați în mod obișnuit).
Notă:
Primerii nou proiectați trebuie să optimizeze condițiile de reacție și să verifice acuratețea, precizia și limita de detecție a detecției înainte de a efectua detecția la scară largă.
Pasul 2:Elaborați protocolul experimental

Control pozitiv: Utilizați ADN-ul purificat care conține fragmentul țintă ca șablon pentru a determina dacă sistemul de reacție PCR și condițiile sunt normale.
Control negativ/blank: utilizați un șablon ADN sau ddH2O care nu conține fragmentul țintă ca șablon pentru a detecta dacă există o sursă de contaminare în sistemul PCR.
Control intern de referință: utilizați combinația primer/sondă a genei endogene a probei de testat pentru a evalua dacă șablonul poate fi detectat prin PCR.
Notă:
Pentru fiecare test trebuie setate controale pozitive, negative/martor și controale de control intern pentru a evalua validitatea rezultatelor experimentale.
Pasul 3: Pregătirea experimentului

Înainte de utilizare, observați dacă soluția este amestecată uniform.Dacă se găsește precipitații, aceasta trebuie dizolvată și amestecată conform instrucțiunilor înainte de utilizare.Amestecul 2×PCR trebuie pipetat și amestecat în mod repetat cu o micropipetă înainte de utilizare pentru a evita distribuția neuniformă a ionilor.
Notă:
Scoateți instrucțiunile și citiți-le cu atenție și faceți pregătiri înainte de experiment, în strictă conformitate cu instrucțiunile.
Pasul 4: Pregătiți sistemul de reacție PCR
Conform protocolului experimental, amestecați primerii, H2O, 2×PCR se amestecă, se centrifughează și se distribuie în fiecare tub de reacție.
Notă:
Pentru testarea pe scară largă sau pe termen lung, se recomandă utilizarea unui sistem de reacție PCR care conține enzima UNG, care poate evita eficient contaminarea cu aerosoli cauzată de produsele PCR.
Pasul 5: Adăugați șablonul de reacție

Folosind tehnologia Direct PCR, nu este nevoie de un proces obositor de purificare a acidului nucleic.Șablonul de probă poate fi preparat în 10 minute și adăugat la sistemul de reacție PCR corespunzător.
Notă:
Metoda Lysis are un efect de detecție mai bun, iar produsul obținut poate fi folosit pentru mai multe reacții de detecție.
5.1: PCR directă a frunzelor
În funcție de dimensiunea imaginii din manual, tăiați țesutul frunzei cu un diametru de 2-3mm și plasați-l în sistemul de reacție PCR.
Notă: Asigurați-vă că fragmentele de frunze sunt complet scufundate în soluția de reacție PCR și nu adăugați țesut de frunze în exces.
5.2: Metoda lizei frunzelor
Tăiați țesutul de frunze cu un diametru de 5-7 mm și puneți-l într-un tub de centrifugă.Dacă alegeți frunze mature, vă rugăm să evitați utilizarea țesuturilor din nervura principală a frunzei.Se pipetează 50ul de lizat tampon P1 într-un tub de centrifugă pentru a se asigura că lizatul poate scufunda complet țesutul frunzelor, se pune într-un termociclator sau într-o baie de metal și se lizează la 95°C timp de 5-10 minute.


Se adaugă 50ul de soluție de neutralizare tampon P2 și se amestecă bine.Lizatul rezultat poate fi utilizat ca șablon și adăugat la sistemul de reacție PCR.
Notă: Cantitatea de șablon trebuie să fie între 5-10% din sistemul PCR și nu trebuie să depășească 20% (de exemplu, într-un sistem PCR de 20μl, adăugați 1-2μl de tampon de liză, nu mai mult de 4μl).
Pasul 6: Reacția PCR

După centrifugarea tubului de reacție PCR, plasați-le într-un instrument PCR pentru amplificare.
Notă:
Reacția folosește șablon nepurificat pentru amplificare, astfel încât numărul de cicluri de amplificare este cu 5-10 mai multe cicluri decât atunci când se utilizează șablon ADN purificat.
Pasul 7: Detectarea electroforezei și analiza rezultatelor

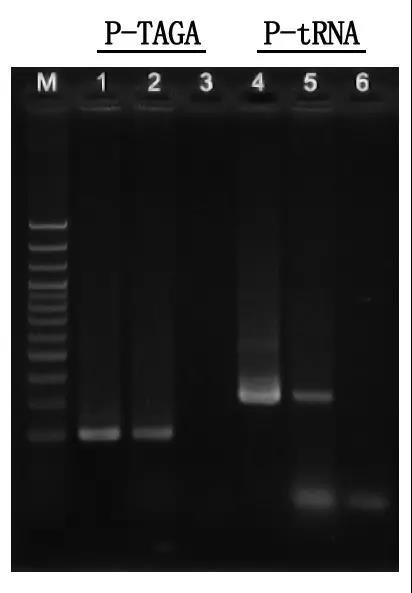
M: Scara ADN de 100 pb
1\4: Metoda ADN purificat
2\5: Metoda PCR directă
3\6: Control gol
Control de calitate:
Rezultatele testelor diferitelor controale stabilite în experiment ar trebui să îndeplinească următoarele condiții.În caz contrar, cauza problemei ar trebui analizată, iar testul trebuie efectuat din nou după ce problema este eliminată.
Tabelul 1. Rezultatele testelor normale ale diferitelor grupuri de control

*Când plasmida este utilizată ca martor pozitiv, rezultatul testului genei endogene poate fi negativ
Judecata de rezultat:
A. Rezultatul testului genei endogene a probei este negativ, indicând faptul că ADN-ul potrivit pentru detectarea PCR obișnuită nu poate fi extras din probă sau ADN-ul extras conține inhibitori de reacție PCR și ADN-ul trebuie extras din nou.
B. Rezultatul testului genei endogene a probei este pozitiv, iar rezultatul testului genei exogene este negativ, indicând faptul că ADN-ul potrivit pentru detectarea PCR obișnuită este extras din probă și se poate aprecia că gena XXX nu este detectată în probă.
C. Rezultatul testului genei endogene a probei este pozitiv, iar rezultatul testului genei exogene este pozitiv, ceea ce indică faptul că ADN-ul potrivit pentru detectarea PCR obișnuită a fost extras din probă, iar proba de ADN conține gena XXX.Experimentele de confirmare pot fi efectuate în continuare.
Pasul 8: Proiectați amorsele de detectare

După experiment, utilizați soluție de hipoclorit de sodiu 2% și soluție de etanol 70% pentru a șterge zona experimentală pentru a preveni poluarea mediului.
Apendice
Tabelul 2. Primeri utilizați în mod obișnuit pentru detectarea generală prin PCR a plantelor modificate genetic
Document de referință:
SN/T 1202-2010, Metoda calitativă de detecție PCR a ingredientelor vegetale modificate genetic din alimente.
Anuntul Ministerului Agriculturii 1485-5-2010, Testarea ingredientelor plantelor modificate genetic si a produselor acestora-orez M12 si derivatele acestuia.
Ora postării: iunie-09-2021








