Ⅰ. Creșteți sensibilitatea sistemului de reacție:
1. Separați ARN de înaltă calitate:
Sinteza de succes a ADNc provine din ARN de înaltă calitate.ARN-ul de înaltă calitate ar trebui să asigure cel puțin o perioadă totală mai lungă și nu conține inhibitori care nu conțin enzime de înregistrare, cum ar fi EDTA sau SDS.Calitatea ARN-ului determină valoarea maximă a informațiilor de secvență pe care o puteți transcrie în ADNc.Metoda generală de purificare a ARN este o metodă în etape de utilizare a izoocianat/acidofenol.Pentru a preveni poluarea cu RNază, ARN-ul separat dintr-o probă bogată în RNază (cum ar fi pancreasul) necesită depozitarea formaldehidei pentru a salva ARN de înaltă calitate, ceea ce este cu atât mai mult pentru depozitarea pe termen lung.ARN-ul extras din ficatul de șobolan a fost practic degradat după o săptămână de depozitare în apă, în timp ce ARN-ul extras din splina de șobolan a rămas stabil după trei ani de depozitare în apă.În plus, transcrierile mai mari de 4 kb sunt mai sensibile la degradarea urmelor RNazei decât transcrierile mici.Pentru a crește stabilitatea probei de ARN de stocare, ARN-ul poate fi dizolvat într-o metamamină de ion și este stocat la -70 °C.Tilidul folosit pentru salvarea ARN-ului nu trebuie să conțină un obiect divers care degradează ARN-ul.ARN-ul, care este derivat din pancreas, poate fi salvat în metamamină timp de cel puțin un an.Când sunteți gata să utilizați ARN, puteți utiliza următoarele metode pentru a precipita ARN: adăugați NaCl la 0,2 m și de 4 ori volumul de etanol, plasați temperatura camerei timp de 3-5 minute și 10.000 × g centrifugal timp de 5 minute.
2. Utilizați transcriptază inversă fără activitate RNaseH (RNaseH-):
Inhibitorii de RNază sunt adesea adăugați la reacțiile de transcripție inversă pentru a crește lungimea și randamentul sintezei cADN.Inhibitorul de RNază este adăugat în prima reacție de sinteză în lanț în prezența tampoanelor și a agenților reducători, cum ar fi DTT, deoarece procesul de sinteză pre-ADNc denaturează inhibitorul, eliberând astfel RNazele legate care degradează ARN-ul.Inhibitorul proteic RNazei previne doar degradarea ARN de către RNaza A, B, C și nu previne RNazele pe piele, așa că trebuie avut grijă să nu se introducă RNaze de la degete în ciuda utilizării acestor inhibitori.
Reverse transcriptaza catalizează conversia ARN-ului în cADN.Atât M-MLV, cât și AMV au activitate endogenă RNaseH în plus față de propria lor activitate de polimerază.Activitatea RNaseH concurează cu activitatea polimerazei pentru catenele heterozigote formate între matrițele de ARN și primerii ADN sau catenele de extensie a ADNc și degradează catenele ARN: ARN în complexele ADN.Șabloanele de ARN degradate de activitatea RNaseH nu mai pot fi utilizate ca substraturi eficiente pentru sinteza cADN, reducând randamentul și lungimea sintezei cADN-ului.Astfel, eliminarea sau reducerea semnificativă a activității RNaseH a transcriptazei inverse ar fi de mare beneficiu.
Transcriptaza inversă SuperScriptⅡ, transcriptaza inversă MMLV a RNaseH- și transcriptaza inversă thermoScript, AMV a RNaseH- au produs mai mult ADNc de lungime completă decât MMLV și AMV.Sensibilitatea RT-PCR este afectată de cantitatea de ADNc sintetizat.ThermoScript este mult mai sensibil decât AMV.Dimensiunea produselor RT-PCR este limitată de capacitatea transcriptazei inverse de a sintetiza ADNc, în special atunci când se clonează Cdna mai mari.În comparație cu MMLV, SuperScripⅡ a crescut semnificativ randamentul produselor RT-PCR lungi.Reverse transcriptaza RNaseH- crește, de asemenea, stabilitatea termică, astfel încât reacția poate fi efectuată la temperaturi mai mari decât cele normale, de 37-42℃.În condițiile de sinteză sugerate, au fost utilizați primeri oligo(dT) și 10μCi [alfa-p]dCTP.Producția totală a primului lanț a fost calculată folosind metoda de precipitare TCA.ADNc de lungime completă a fost analizat utilizând îndepărtarea benzilor sortate în funcție de mărime și numărarea într-un gel de agaroză alcalină.
3. Creșteți temperatura de conservare a căldurii a transcripției inverse:
Temperatura de menținere mai mare ajută la deschiderea structurii secundare a ARN și la creșterea randamentului reacției.Pentru majoritatea modelelor de ARN, menținerea ARN-ului și primerului la 65°C fără tampon sau sare și apoi răcirea lor rapidă pe gheață elimină majoritatea structurilor secundare și permite primerilor să se lege.Cu toate acestea, unele șabloane au încă structură secundară, chiar și după denaturarea termică.Amplificarea acestor șabloane dificile poate fi realizată utilizând transcriptază inversă ThermoScript și plasând reacția transcriptazei inverse la temperaturi mai ridicate pentru a îmbunătăți amplificarea.Temperaturile mai mari de menținere pot crește, de asemenea, specificitatea, în special atunci când sinteza cADN-ului este efectuată folosind primeri specifici genei (GSPS) (vezi capitolul 3).Dacă utilizați GSP, asigurați-vă că valoarea Tm a grundului este aceeași cu temperatura de menținere așteptată.Nu utilizați oligo(dT) și primeri aleatoriu peste 60℃.Amorsele aleatorii trebuie ținute la 25℃ timp de 10 minute înainte de a crește la 60℃.În plus față de utilizarea temperaturilor de transcripție inversă mai ridicate, specificitatea poate fi îmbunătățită prin transferul direct a amestecului de ARN/primer de la temperatura de denaturare de 65℃ la temperatura de menținere a transcripției inverse și adăugând un amestec de reacție preîncălzit 2x (sinteza de inițiere termică cADN).Această abordare ajută la prevenirea împerecherii de baze intermoleculare care are loc la temperaturi mai scăzute.Utilizarea unui instrument PCR simplifică numeroasele comutatoare de temperatură necesare pentru RT-PCR.
Polimeraza T-a stabilizată la căldură acționează ca ADN polimerază în prezența Mg2+ și ARN polimerază în prezența Mn2+.Poate reține căldura până la 65℃.Cu toate acestea, prezența Mn2+ în timpul PCR reduce fidelitatea, ceea ce face ca polimeraza Tth să fie mai puțin potrivită pentru amplificarea de înaltă precizie, cum ar fi donarea cADN.În plus, Tth este mai puțin eficient la transcrierea inversă, ceea ce reduce sensibilitatea și, deoarece o singură enzimă poate efectua transcripție inversă și PCR, reacțiile de control fără transcripție inversă nu pot fi utilizate pentru a distinge produsele amplificate ale ADNc de cele ale ADN-ului genomic contaminat.
4. Aditiv care promovează transcrierea inversă:
Adăugarea de aditivi, inclusiv glicerină și DMSO, la prima reacție de sinteză în lanț poate reduce stabilitatea dublei catete a acidului nucleic și poate desface structura secundară a ARN.Se pot adăuga până la 20% glicerină sau 10% DMSO fără a afecta activitatea SuperScriptⅡ sau MMLV.AMV poate tolera, de asemenea, până la 20% glicerol fără a reduce activitatea.Pentru a maximiza sensibilitatea RT-PCR în reacția de transcripție inversă SuperScriptⅡ, se poate adăuga 10% glicerol și izola la 45℃.Dacă la PCR se adaugă 1/10 din produsul de reacție de retrotranscripție, concentrația de glicerol în reacția de amplificare este de 0,4%, ceea ce nu este suficient pentru a inhiba PCR.
5. Procesarea RNaseH:
Sensibilitatea poate fi îmbunătățită prin tratarea reacțiilor de sinteză a ADNc cu RNaseH înainte de PCR.Pentru unele șabloane, se crede că ARN-ul din reacția de sinteză a ADNc previne legarea produselor amplificate, caz în care tratamentul cu RNaseH poate crește sensibilitatea.În general, tratamentul cu RNaseH este necesar pentru amplificarea unui șablon țintă de ADNc de lungime completă relativ lung, cum ar fi scheroza tuberoasăⅡ cu copie scăzută.Pentru acest șablon dificil, RNaseH a îmbunătățit semnalul generat de cADN-ul sintetizat de SuperScriptⅡ sau AMV.Pentru majoritatea reacțiilor RT-PCR, tratamentul cu RNaseH este opțional deoarece etapa de denaturare a PCR izolată la 95℃ hidrolizează de obicei ARN-ul din complexul ARN: ADN.
6. Metode îmbunătățite pentru detectarea cantităților mici de ARN:
RT-PCR este deosebit de dificilă atunci când sunt disponibile doar cantități mici de ARN.Adăugarea de glicogen ca purtător în timpul separării ARN ajută la creșterea randamentului probelor mici.Un glicogen fără RNază poate fi adăugat în același timp cu Trizol.Glicogenul este solubil în apă și poate rămâne în faza apoasă cu ARN pentru a ajuta la precipitarea ulterioară.Concentrația recomandată de glicogen fără RNază este de 250 μg/ml pentru probe mai mici de 50 mg de țesut sau 106 celule cultivate.
Adăugarea de BSA acetilat la reacțiile de transcripție inversă folosind SuperScriptⅡ poate crește sensibilitatea, iar pentru cantități mici de ARN, reducerea cantității de SuperScriptⅡ și adăugarea a 40 de unități de inhibitor de nuclează RnaseOut poate îmbunătăți nivelul de detectare.Dacă glicogenul este utilizat în separarea ARN-ului, adăugarea de inhibitori de BSA sau RNază la reacțiile de transcripție inversă folosind SuperScriptⅡ este totuși recomandată.
Ⅱ. Creșteți specificitatea RT-PCR
1. Sinteza cNDA:
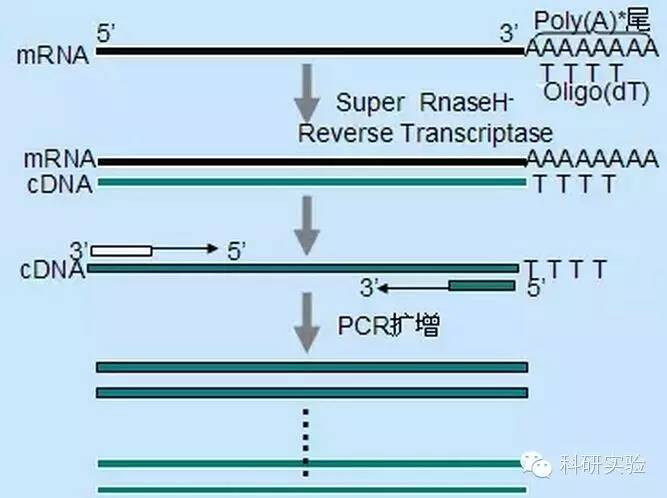
Pot fi utilizate trei metode diferite pentru a iniția sinteza de ADNc a primei catene, iar specificitatea relativă a fiecărei metode afectează cantitatea și tipul de ADNc sintetizat.
Metoda de amorsare aleatorie este cea mai puțin specifică dintre cele trei metode.Primerii sunt recoapți în mai multe locuri de-a lungul transcriptului pentru a produce ADNc de lungime parțială scurtă.Această metodă este adesea folosită pentru a obține secvențe terminale 5′ și ADNc din matrițe de ARN cu regiuni structurale secundare sau cu situsuri de terminare care transcriptaza inversă nu se poate replica.Pentru a obține cel mai lung ADNc, raportul dintre primeri și ARN din fiecare probă de ARN trebuie determinat empiric.Concentrația inițială a primerilor aleatori variază de la 50 la 250ng per 20μl de sistem de reacție.Deoarece cADN-ul sintetizat din ARN total folosind primeri aleatori este în principal ARN ribozomal, poli(A)+ARN este în general selectat ca șablon.
Inițierea oligo(dT) este mai specifică decât primerii aleatori.Se hibridizează cu coada poli(A) găsită la capătul 3′ al ARNm în majoritatea celulelor eucariote.Deoarece poli(A)+ARN reprezintă aproximativ 1% până la 2% din ARN total, cantitatea și complexitatea ADNc este mult mai mică decât dacă ar fi utilizați primeri aleatori.Datorită specificității sale ridicate, oligo(dT) în general nu necesită optimizare pentru raportul ARN la primer și selecția poli(A)+.Se recomandă utilizarea a 0,5μg oligo(dT) per 20μl de sistem de reacție.oligo(dT)12-18 este potrivit pentru majoritatea RT-PCR.Sistemul ThermoScript RT-PCR oferă oligo(dT)20 datorită stabilității sale termice bune și este potrivit pentru temperaturi de menținere mai ridicate.
Primerii specifici genei (GSP) sunt cei mai buni primeri specifici pentru etapa de transcriere inversă.GSP este o oligonucleozidă antisens care poate hibridiza în mod specific cu secvențele de destinație ARN, mai degrabă decât să recoace toate Rna, cum ar fi primeri aleatori sau oligo(dT).Regulile utilizate pentru proiectarea primerilor PCR se aplică și proiectării reacției de transcripție inversă GSP.GSP poate fi aceeași secvență ca primerul de amplificare recoapt la sfârșitul ARNm3', sau GSP poate fi proiectat pentru a fi coapat în aval cu primerul de amplificare inversă.Pentru unele obiecte amplificate, este necesar să se proiecteze mai mult de un primer antisens pentru RT-PCR de succes, deoarece structura secundară a ARN-ului țintă poate împiedica legarea primerului.Se sugerează să se folosească 1 pmol GSP antisens în primul sistem de reacție de sinteză în lanț de 20μl.
2. Creșteți temperatura de conservare a căldurii a transcripției inverse:
Pentru a profita pe deplin de specificitatea GSP, ar trebui utilizată transcriptaza inversă cu stabilitate termică ridicată.Transcriptaza inversă stabilă la căldură poate fi izolată la temperaturi mai ridicate pentru a crește rigoarea reacției.De exemplu, dacă un GSP este recoapt la 55°C, atunci specificitatea GSP nu este utilizată pe deplin dacă transcrierea inversă este efectuată la 37°C cu rigoare scăzută folosind AMV sau M-MLV.Cu toate acestea, SuperScripⅡ și ThermoScript pot reacționa la 50℃ sau mai mult, ceea ce elimină produsele nespecifice produse la temperaturi mai scăzute.Pentru o specificitate maximă, amestecul de ARN/primer poate fi transferat direct de la temperatura de denaturare de 65℃ la temperatura de menținere a transcripției inverse cu adăugarea unui amestec de reacție preîncălzit de 2 x (inițierea termică a sintezei ADNc).Acest lucru ajută la prevenirea împerecherii bazelor între molecule la temperaturi scăzute.Utilizarea unui instrument PCR simplifică numeroasele tranziții de temperatură necesare pentru RT-PCR.
3. Reduceți contaminarea ADN-ului genomic:
O posibilă dificultate cu RT-PCR este că ARN-ul contaminează ADN-ul genomic.Utilizarea unor metode mai bune de separare a ARN, cum ar fi reactivul Trizol, reduce contaminarea ADN-ului genomic în preparatele de ARN.Pentru a evita produsele produse din ADN-ul genomic, ARN-ul poate fi tratat cu ADNⅠ de grad de amplificare pentru a elimina ADN-ul contaminat înainte de transcrierea inversă.Probele au fost menținute la 65 ℃ în 2,0 mM EDTA timp de 10 minute pentru a termina digestia ADNazeiⅠ.EDTA chelatează ionii de magneziu pentru a preveni hidroliza ARN dependentă de ionii de magneziu care are loc la temperaturi ridicate.
Pentru a separa ADNc amplificat de produsul de amplificare a ADN-ului genomului, pot fi proiectați primeri care se recoacă separat cu exonul separat.Produsele PCR derivate din ADNc vor fi mai scurte decât cele derivate din ADN-ul genomic contaminat.Un experiment controlat fără transcripție inversă este de asemenea efectuat pe fiecare matriță de ARN pentru a determina dacă un fragment dat provine din ADN genomic sau ADNc.Produsele PCR obținute în absența transcripției inverse sunt derivate din genom.
Produs înrudit
-Ktul într-un singur pas permite efectuarea transcripției inverse și a PCR în același tub.Trebuie doar să adauge ARN șablon, primeri specifici PCR și ddH fără RNază2O.
-Analiza cantitativă în timp real a ARN-ului poate fi efectuată rapid și precis.
-Ktul folosește un reactiv unic de transcripție inversă Foregene și Foregene HotStar Taq DNA Polymerase combinate cu un sistem de reacție unic pentru a îmbunătăți eficient eficiența amplificării și specificitatea reacției.
- Sistemul de reacție optimizat face ca reacția să aibă o sensibilitate de detecție mai mare, o stabilitate termică mai puternică și o toleranță mai bună.
- Capacitate eficientă de a elimina gDNA, care poate elimina gDNA din șablon în decurs de 2 minute.
- Sistem eficient de transcripție inversă, durează doar 15 minute pentru a finaliza sinteza primei catene de ADNc.
-Șabloane complexe: șabloanele cu conținut ridicat de GC și structură secundară complexă pot fi, de asemenea, inversate cu eficiență ridicată.
-Sistem de transcripție inversă de înaltă sensibilitate, șabloanele la nivel pg pot obține, de asemenea, ADNc de înaltă calitate.
-Sistemul de transcripție inversă are stabilitate termică ridicată, temperatura optimă de reacție este de 42℃ și are încă o performanță bună de transcriere inversă la 50℃.
Ora postării: Mar-07-2023