Anticorpii, numiți și imunoglobuline (Ig), sunt glicoproteine care se leagă în mod specific la antigene.
Prepararea convențională de anticorpi este produsă prin imunizarea animalelor și colectarea antiserului.Prin urmare, antiserul conține de obicei anticorpi împotriva altor antigeni neînrudiți și a altor componente proteice din ser.Moleculele de antigen general conțin în cea mai mare parte mai mulți epitopi diferiți, astfel încât anticorpii convenționali sunt, de asemenea, un amestec de anticorpi împotriva mai multor epitopi diferiți.Chiar și anticorpii serici convenționali direcționați împotriva aceluiași epitop sunt încă compuși din anticorpi eterogene produși de diferite clone de celule B.Prin urmare, anticorpii serici convenționali sunt numiți și anticorpi policlonali sau, pe scurt, anticorpi policlonali.
Anticorpul monoclonal (anticorpul monoclonal) este un anticorp extrem de uniform produs de o singură clonă de celule B și direcționat numai împotriva unui epitop specific.De obicei, este preparat prin tehnologia hibridomului - tehnologia anticorpilor hibridom se bazează pe tehnologia de fuziune celulară, combinând celulele B cu capacitatea de a secreta anticorpi specifici și celule de mielom cu capacitate infinită de creștere în hibridoame cu celule B.Această celulă hibridom are caracteristicile unei celule părinte.Poate prolifera la nesfârșit și nemuritor in vitro ca și celulele de mielom și poate sintetiza și secreta anticorpi specifici precum limfocitele splenice.Prin donare, se poate obține o linie monoclonală derivată dintr-o singură celulă hibridom, adică o linie celulară hibridom.Anticorpii pe care îi produce sunt anticorpi foarte omogeni împotriva aceluiași determinant antigenic, adică anticorpi monoclonali.
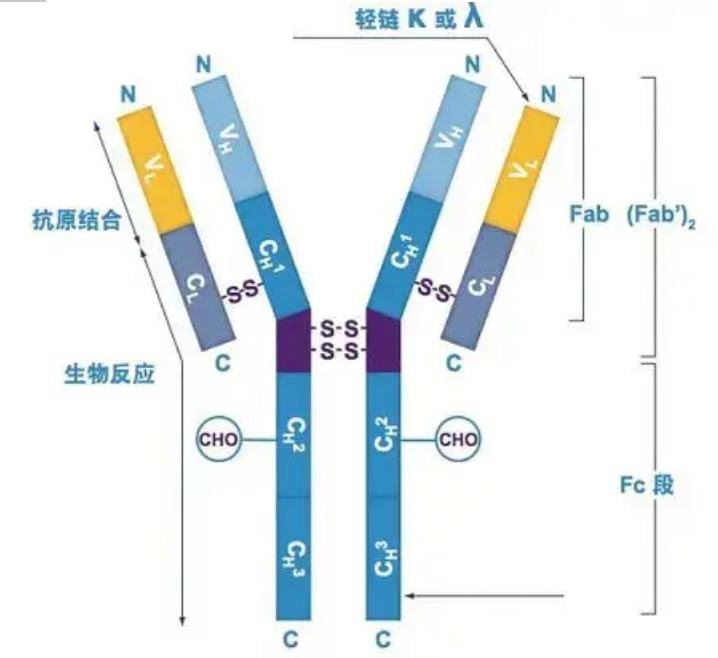
Anticorpii există ca unul sau mai mulți monomeri în formă de Y (adică, anticorpi monoclonali sau anticorpi policlonali).Fiecare monomer în formă de Y este compus din 4 lanțuri polipeptidice, inclusiv două lanțuri grele identice și două lanțuri ușoare identice.Lanțul ușor și lanțul greu sunt denumite în funcție de greutatea lor moleculară.Partea superioară a structurii în formă de Y este regiunea variabilă, care este locul de legare a antigenului.(Fragment din Detai Bio-Monoclonal Antibody Concept)
Structura anticorpilor
 Lanț greu
Lanț greu
Există cinci tipuri de lanțuri grele de Ig de mamifere, numite cu literele grecești α, δ, ε, γ și μ.Anticorpii corespunzători se numesc IgA, IgD, IgE, IgG și IgM.Diferite lanțuri grele diferă în dimensiune și compoziție.α și γ conțin aproximativ 450 de aminoacizi, în timp ce μ și ε conțin aproximativ 550 de aminoacizi.
Fiecare lanț greu are două regiuni: regiunea constantă și regiunea variabilă.Toți anticorpii de același tip au aceeași regiune constantă, dar există diferențe între anticorpii de diferite tipuri.Regiunile constante ale lanțurilor grele γ, α și δ sunt compuse din trei domenii Ig în tandem, cu o regiune balama pentru a crește flexibilitatea acesteia;regiunile constante ale lanțurilor grele μ și ε sunt compuse din 4 domenii Ig.Regiunea variabilă a lanțului greu al anticorpului produs de celule B diferite este diferită, dar regiunea variabilă a anticorpului produs de aceeași celulă B sau clonă de celulă este aceeași, iar regiunea variabilă a fiecărui lanț greu are o lungime de aproximativ 110 aminoacizi., Și formează un singur domeniu Ig.
Lanț ușor
Există doar două tipuri de lanțuri ușoare la mamifere: tipul lambda și tipul kappa.Fiecare lanț ușor are două domenii legate: o regiune constantă și o regiune variabilă.Lungimea lanțului ușor este de aproximativ 211 ~ 217 aminoacizi.Cele două lanțuri ușoare conținute în fiecare anticorp sunt întotdeauna aceleași.Pentru mamifere, lanțul ușor din fiecare anticorp are un singur tip: kappa sau lambda.La unele vertebrate inferioare, cum ar fi peștii cartilaginoși (peștii cartilaginos) și peștii osoși, se găsesc și alte tipuri de lanțuri ușoare precum tipul iota (iota).
Segmentele Fab și Fc
Segmentul Fc poate fi combinat direct cu enzime sau coloranți fluorescenți pentru a marca anticorpii.Este partea în care anticorpul nituri pe placă în timpul procesului ELISA și este, de asemenea, partea în care al doilea anticorp este recunoscut și legat în imunoprecipitare, imunoblot și imunohistochimie.Anticorpii pot fi hidrolizați în două segmente F(ab) și un segment Fc de către enzime proteolitice, cum ar fi papaina, sau pot fi rupti din regiunea balama de către pepsină și hidrolizați într-un segment F(ab)2 și un segment Fc.Fragmentele de anticorpi IgG sunt uneori foarte utile.Din cauza lipsei segmentului Fc, segmentul F(ab) nu va precipita cu antigenul și nici nu va fi captat de celulele imune în studiile in vivo.Din cauza fragmentelor moleculare mici și a lipsei funcției de reticulare (datorită lipsei segmentului Fc), segmentul Fab este de obicei utilizat pentru radiomarcare în studiile funcționale, iar segmentul Fc este utilizat în principal ca agent de blocare în colorarea histochimică.
Regiuni variabile și constante
Regiunea variabilă (regiunea V) este situată la 1/5 sau 1/4 (conținând aproximativ 118 resturi de aminoacizi) din lanțul H lângă capătul N-terminal și 1/2 (conținând aproximativ 108-111 resturi de aminoacizi) lângă capătul N-terminal al lanțului L.Fiecare regiune V are un inel peptidic format din legături disulfurice intra-lanţ, iar fiecare inel peptidic conţine aproximativ 67 până la 75 de resturi de aminoacizi.Compoziția și aranjarea aminoacizilor în regiunea V determină specificitatea de legare a antigenului a anticorpului.Datorită tipurilor și secvenței în continuă schimbare de aminoacizi din regiunea V, pot fi formate multe tipuri de anticorpi cu specificități diferite de antigen de legare.Regiunile V ale lanțului L și ale lanțului H se numesc VL și, respectiv, VH.În VL și VH, compoziția și secvența de aminoacizi a unor regiuni locale au un grad mai mare de variație.Aceste regiuni sunt numite regiuni hipervariabile (HVR).Compoziția de aminoacizi și aranjarea părților non-HVR în regiunea V sunt relativ conservatoare, ceea ce se numește regiunea cadru.Există trei regiuni hipervariabile în VL, de obicei situate la resturile de aminoacizi 24 până la 34 și, respectiv, 89 până la 97.Cele trei HVR ale VL și VH se numesc HVR1, HVR2 și, respectiv, HVR3.Cercetările și analiza difracției cu cristale de raze X au demonstrat că regiunea hipervariabilă este într-adevăr locul în care se leagă antigenul anticorpului, deci este numită regiunea determinantă a complementarității (CDR).HVR1, HVR2 și HVR3 ale VL și VH pot fi numite CDR1, CDR2 și, respectiv, CDR3.În general, CDR3 are un grad mai mare de hipervariabilitate.Regiunea hipervariabilă este, de asemenea, principala locație în care există determinanții idiotipici ai moleculelor de Ig.În cele mai multe cazuri, lanțul H joacă un rol mai important în legarea de antigen.
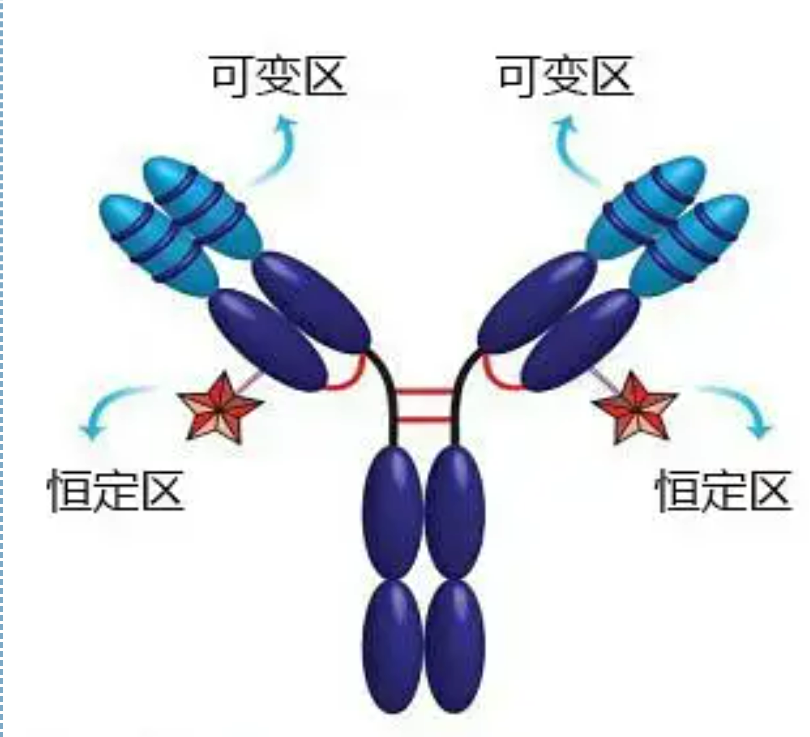 Regiunea constantă (regiunea C)este situat la 3/4 sau 4/5 (aproximativ de la aminoacidul 119 la terminalul C) al lanțului H lângă capătul C terminal și 1/2 (conține aproximativ 105 resturi de aminoacizi) lângă capătul C terminal al lanțului L.Fiecare regiune funcțională a lanțului H conține aproximativ 110 resturi de aminoacizi și conține un inel peptidic compus din 50-60 de resturi de aminoacizi conectate prin legături disulfură.Compoziția și aranjamentul de aminoacizi a acestei regiuni sunt relativ constante în același lanț de izotip L de Ig animal și același lanț de tip H.La fel, se poate lega în mod specific doar la antigenul corespunzător, dar structura regiunii sale C este aceeași, adică are aceeași antigenitate.Anticorpul secundar de cal anti-IgG uman (sau anti-anticorp) poate fi combinat cu cei doi Apare o combinație de anticorpi (IgG) împotriva diferitelor exotoxine.Aceasta este o bază importantă pentru prepararea anticorpilor secundari și aplicarea fluoresceinei, izotopilor, enzimelor și a altor anticorpi marcați.
Regiunea constantă (regiunea C)este situat la 3/4 sau 4/5 (aproximativ de la aminoacidul 119 la terminalul C) al lanțului H lângă capătul C terminal și 1/2 (conține aproximativ 105 resturi de aminoacizi) lângă capătul C terminal al lanțului L.Fiecare regiune funcțională a lanțului H conține aproximativ 110 resturi de aminoacizi și conține un inel peptidic compus din 50-60 de resturi de aminoacizi conectate prin legături disulfură.Compoziția și aranjamentul de aminoacizi a acestei regiuni sunt relativ constante în același lanț de izotip L de Ig animal și același lanț de tip H.La fel, se poate lega în mod specific doar la antigenul corespunzător, dar structura regiunii sale C este aceeași, adică are aceeași antigenitate.Anticorpul secundar de cal anti-IgG uman (sau anti-anticorp) poate fi combinat cu cei doi Apare o combinație de anticorpi (IgG) împotriva diferitelor exotoxine.Aceasta este o bază importantă pentru prepararea anticorpilor secundari și aplicarea fluoresceinei, izotopilor, enzimelor și a altor anticorpi marcați.
Produse asemanatoare:
Kit Cell Direct RT-qPCR
Ora postării: 30-sept-2021








