1. Înțelegerea inițială
În această etapă, trebuie să înțelegem câteva concepte și terminologie, pentru a evita greșelile în fața seniorilor noștri, cum ar fi:
Î: Care este diferența dintre RT-PCR, qPCR, PCR în timp real și RT-PCR în timp real?
Răspuns: RT-PCR este PCR cu transcripție inversă(PCR cu transcripție inversă, RT-PCR), care este o variantă utilizată pe scară largă a reacției în lanț a polimerazei (PCR).În RT-PCR, o catenă de ARN este transcrisă invers în ADN complementar, care este apoi utilizat ca matriță pentru amplificarea ADN-ului prin PCR.
PCR în timp real și qPCR(Cantitative Rea-ltime-PCR) sunt același lucru, ambele sunt PCR cantitative în timp real, ceea ce înseamnă că fiecare ciclu de PCR are înregistrări de date în timp real, astfel încât numărul de șabloane de pornire poate fi ajustat analiză precisă.
Deși atât PCR în timp real (PCR cantitativ fluorescent în timp real) cât și PCR cu transcripție inversă (PCR cu transcriere inversă) par a fi abreviate ca RT-PCR, convenția internațională este: RT-PCR se referă în mod specific la transcrierea inversă.PCR, PCR în timp real este în general abreviat ca qPCR (PCR cantitativ în timp real).
Și RT-PCR în timp real (RT-qPCR), este PCR cu transcripție inversă combinată cu tehnologia cantitativă fluorescentă: obțineți mai întâi cADN (RT) din transcripția inversă ARN și apoi utilizați PCR în timp real pentru analiza cantitativă (qPCR).Majoritatea laboratoarelor fac RT-qPCR, adică cercetări privind reglarea în jos a expresiei ARN, așa că qPCR-ul despre care vorbește toată lumea în laborator se referă de fapt la RT-qPCR, dar nu uitați că există încă multe teste ADN în aplicații clinice.Analiza cantitativă, cum ar fi detectarea virusului hepatitei B VHB.
Întrebare: După citirea multor PCR cantitative fluorescente, de ce ar trebui să fie controlat fragmentul amplificat în intervalul 80-300bp?
Răspuns: Lungimea fiecărei secvențe de genă este diferită, unele sunt de mai mulți kb, altele sunt de sute de bp, dar trebuie să cerem doar ca lungimea produsului să fie de 80-300 bp atunci când proiectăm primeri, prea scurte sau prea lungi nu sunt potrivite pentru detectarea fluorescentă cantitativă PCR.Fragmentul de produs este prea scurt pentru a fi distins de primer-dimer.Lungimea primer-dimerului este de aproximativ 30-40 pb și este dificil de distins dacă este un primer-dimer sau un produs dacă este mai mic de 80 pb.Dacă fragmentul de produs este prea lung, depășește 300 bp, va duce cu ușurință la o eficiență scăzută de amplificare și nu poate detecta eficient cantitatea de genă.
De exemplu, când numărați câți oameni sunt într-o sală de clasă, trebuie doar să numărați câte guri sunt.Același lucru este valabil atunci când detectezi gene, trebuie doar să detectezi o anumită secvență a unei gene pentru a reprezenta întreaga secvență.Dacă vrei să numeri oameni, trebuie să numeri atât gura, cât și nasul, urechile și ochelarii și este ușor să faci greșeli.
Pentru a extinde, în cercetarea biologică, există multe cazuri de cercetare de la un punct la altul, deoarece secvența genică a oricărei specii este foarte lungă, este inutil și imposibil să se măsoare toate fragmentele, cum ar fi secvențierea bacteriană 16S, care constă în efectuarea secvenței conservatoare de teste bacteriene pentru a deduce numărul unei anumite populații de bacterii.
Î: Care este lungimea optimă pentru proiectarea primerului qPCR?
Răspuns: În general, lungimea grundului este de aproximativ 20-24 bp, ceea ce este mai bine.Desigur, trebuie să acordăm atenție valorii TM a grundului la proiectarea grundului, deoarece aceasta este legată de temperatura optimă de recoacere.După o mulțime de experimente, s-a dovedit că 60°C este o valoare TM mai bună.Dacă temperatura de recoacere este prea scăzută, va duce cu ușurință la o amplificare nespecifică.Dacă temperatura de recoacere este prea mare, eficiența de amplificare va fi relativ scăzută, vârful curbei de amplificare va începe mai târziu, iar valoarea CT va fi întârziată.
Î: Cum este metoda vopselei diferită de metoda sondei?
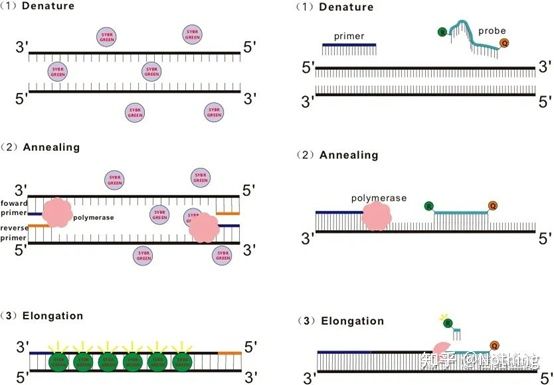
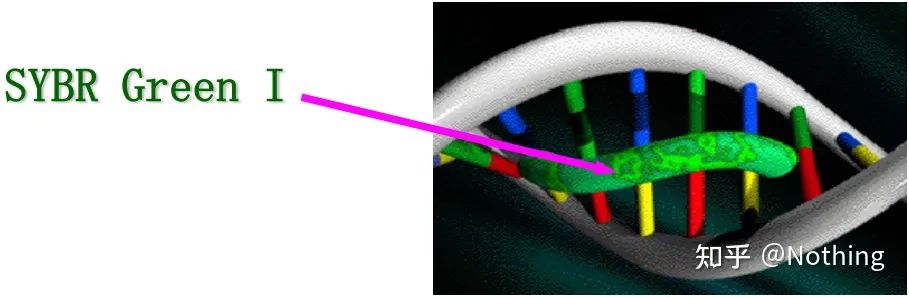
Răspuns: Metoda vopseleiUnii coloranți fluorescenți, cum ar fi SYBR Green Ⅰ, PicoGreen, BEBO etc., nu emit lumină de la sine, dar vor emite fluorescență după ce se leagă de canalul minor al ADN-ului dublu catenar.Prin urmare, la începutul reacției PCR, aparatul nu poate detecta semnalul fluorescent.Când reacția ajunge în stadiul de recoacere-extensiune, dubla catenă este deschisă și o nouă catenă este sintetizată sub acțiunea ADN polimerazei, iar molecula fluorescentă se leagă de canalul minor dsDNA.Pe măsură ce numărul de cicluri PCR crește, din ce în ce mai mulți coloranți sunt combinați cu ADN-ul dublu catenar, iar semnalul fluorescent este, de asemenea, îmbunătățit continuu.Metoda vopselei este utilizată în principal în cercetarea științifică.
PS: Aveți grijă când faceți experimentul, colorantul trebuie combinat cu ADN uman, aveți grijă să îl transformați într-o persoană fluorescentă.
Metoda vopsirii (stânga) Metoda sondei (dreapta)
PS: Aveți grijă când faceți experimentul, colorantul trebuie combinat cu ADN uman, aveți grijă să îl transformați într-o persoană fluorescentă.
SYBR Green Ⅰ se leagă de canalul minor al ADN-ului
Metoda sondeiSonda Taqman este cea mai utilizată sondă de hidroliză.Există un grup fluorescent la capătul 5′ al sondei, de obicei FAM, iar sonda în sine este o secvență complementară genei țintă.Există un grup de stingere fluorescent la capătul 3′.Conform principiului transferului de energie de rezonanță fluorescentă (Förster Resonance Energy Transfer, FRET), atunci când grupul fluorescent reporter (molecula fluorescentă donatoare) și grupul fluorescent de stingere (molecula fluorescentă acceptoare) sunt excitate. nce este slăbit.Prin urmare, la începutul reacției PCR, când sonda este liberă și intactă în sistem, grupul fluorescent reporter nu va emite fluorescență.La recoacere, primerul și sonda se leagă de șablon.În timpul etapei de extensie, polimeraza sintetizează continuu noi lanțuri.ADN polimeraza are activitate exonuclează 5′-3′.Când ajunge la sondă, ADN polimeraza va hidroliza sonda din șablon, va separa grupul fluorescent reporter de grupul fluorescent de extindere și va elibera semnalul fluorescent.Deoarece există o relație unu-la-unu între sondă și șablon, metoda sondei este superioară metodei cu colorare în ceea ce privește acuratețea și sensibilitatea testului.Metoda sondei este utilizată în principal în diagnosticare.
Î: Ce este cuantificarea absolută?Ce este cuantificarea relativă?
Răspuns: Cuantificarea absolută se referă la calcularea numărului de copii inițiale a probei care urmează să fie testată prin qPCR, cum ar fi câți viruși HBV sunt în 1 ml de sânge.Rezultatul obținut prin cuantificare relativă este modificarea cantității de genă țintă dintr-o probă specifică față de o altă probă de referință, iar expresia genei este reglată în sus sau în jos.
Î: Cantitatea de extracție a ARN, eficiența transcripției inverse și eficiența amplificării vor afecta rezultatele experimentale?
Î: Depozitarea probelor, reactivii de extracție, reactivii de transcripție inversă și consumabilele care transmit lumină vor afecta rezultatele experimentale?
Î: Ce metodă poate corecta datele experimentale?
În ceea ce privește aceste probleme, le vom descrie în detaliu în secțiunile avansate și avansate de mai jos.
2. Cunoștințe avansate
În ceea ce privește PCR cantitativ fluorescent în timp real, trebuie să recunoaștem realitatea că mii de lucrări de cercetare științifică sunt publicate în fiecare an, printre care tehnologia PCR cantitativă fluorescentă nu este un număr mic.
Dacă nu există un standard comun pentru măsurarea experimentului PCR cantitativ fluorescent, rezultatele pot varia foarte mult.Pentru aceeași genă a aceleiași specii, cu aceeași metodă de procesare, rezultatele detectării vor varia, de asemenea, foarte mult și va fi dificil pentru cei întârziați să repete aceleași rezultate.Tu Nimeni nu știe care este corect și care este greșit.
Înseamnă asta că PCR cantitativ fluorescent este o tehnologie înșelătorie sau o tehnologie nesigură?Nu, deoarece PCR-ul cantitativ fluorescent este mai sensibil și mai precis, iar o mică operație greșită va produce rezultate complet opuse.O mică pierdere este la o mie de mile distanță.Autorul articolului poate fi torturat în mod repetat de către recenzori.În același timp, recenzorii revistei sunt, de asemenea, greu de ales dintre diferite rezultate experimentale.
Una peste alta, indicând o lipsă de consens în experimentele PCR în timp real.În acest scop, oamenii de știință seniori din industrie au început să formuleze standarde,solicitarea contribuitorilor să furnizeze unele detalii experimentale și de prelucrare a datelor necesare (inclusiv datele necesare) în articol pentru a îndeplini aceste standarde.
Recenziatorii pot judeca calitatea experimentului citind aceste detalii;viitorii cititori îl pot folosi și pentru a repeta experimentul sau pentru a îmbunătăți experimentul.Apoi rezultatele experimentale obținute în acest fel sunt pline de informații, de înaltă calitate și utilizabile.
MIBBI (Informații minime pentru investigații biologice și biomedicale -http://www.mibbi.org) a luat ființă.MIBBI este un proiect care oferă standarde pentru experimente.Este publicat în natură.Acest proiect vizează diverse experimente biologice, inclusiv biologia celulară, Microarray, qPCR despre care vom discuta acum etc. și prevede fiecare tip de experiment atunci când trimitem manuscrise.Aceste informații ar trebui furnizate în orice moment.
În proiectul MIBBI, există două articole legate de PCR cantitativ fluorescent și anume:
· RDML (Real-Time PCR Data Markup Language) – un limbaj structurat și ghid de raportare pentru date PCR cantitative în timp real;
·MIQE (Minimum Information for Publication of Quantitative Real-Time PCR Experiments) – informații minime pentru publicarea articolelor despre experimentele PCR cantitative în timp real.
Mai întâi, să vorbim despre RDML, specificația terminologică.
Dacă nu există o definiție standard pentru tot, este imposibil să continui discuția, motiv pentru care explicarea termenilor este atât de importantă la examen.
Terminologia utilizată în experimentul PCR cantitativ fluorescent include următorul conținut.QIAGEN a făcut cel mai bun rezumat pentru noi.Următoarele sunt toate uscatebunuri .
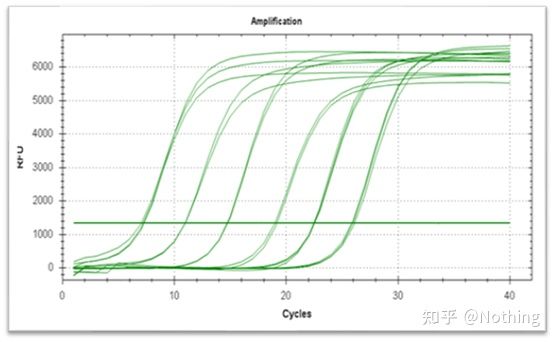
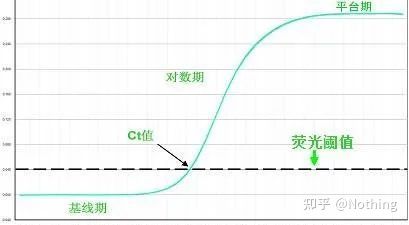
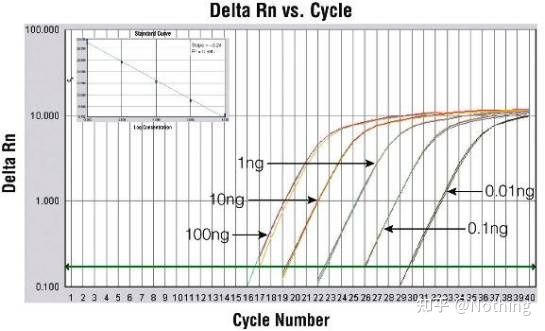
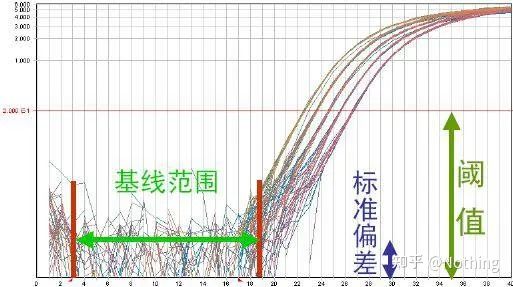
Curba de amplificare
Curba de amplificare se referă la curba realizată în timpul procesului de PCR, cu numărul ciclului ca abscisă și intensitatea fluorescenței în timp real în timpul reacției ca ordonată.
O curbă de amplificare excelentă ar trebui să aibă următoarele caracteristici: linia de bază este plată sau ușor scăzută și nu există o tendință ascendentă evidentă;punctul de inflexiune al curbei este clar, iar panta fazei exponentiale este proportionala cu randamentul de amplificare.Cu cât panta este mai mare, cu atât eficiența de amplificare este mai mare;curba generală de amplificare Paralelismul este bun, indicând faptul că eficiența de amplificare a fiecărui tub este similară;faza exponenţială a curbei de amplificare a probelor cu concentraţie scăzută este evidentă.
Linia de referință (Linia de bază)
Linia de bază este nivelul de zgomot al ciclului timpuriu, măsurată de obicei între ciclul 3 și 15, deoarece creșterea valorii fluorescenței cauzată de produsul de amplificare nu poate fi detectată în această perioadă.Numărul de cicluri utilizate pentru calcularea liniei de bază poate fi variat și poate fi necesar să fie redus dacă sunt utilizate cantități mari de șablon sau dacă nivelul de expresie al genei țintă este ridicat.
Setarea liniei de bază necesită vizualizarea datelor de fluorescență din curba de amplificare a liniarității.Linia de bază este setată astfel încât creșterea curbei de amplificare să înceapă cu un număr de ciclu mai mare decât numărul de vârf al ciclului de bază.Liniile de bază trebuie stabilite individual pentru fiecare secvență țintă.Valorile medii de fluorescență detectate în ciclurile timpurii trebuie să fie scăzute din valorile de fluorescență obținute în produsele amplificate.Cele mai recente versiuni ale diferitelor programe de PCR în timp real permit optimizarea automată a setărilor de bază pentru probe individuale.
În timpul primelor cicluri ale reacției de amplificare PCR, semnalul de fluorescență nu se schimbă prea mult.Apropierea unei linii drepte se numește linie de bază, dar dacă ne uităm îndeaproape la primele câteva cicluri, vedem că în cadrul liniei de bază se află ceea ce se întâmplă în imaginea de mai jos.
Background Background se referă la
valoarea nespecifică a fluorescenței în reacție.De exemplu: stingere ineficientă a fluorescenței;sau un număr mare de șabloane ADN dublu catenar datorită utilizării SYBR Green.Componentele de fundal ale semnalului sunt eliminate matematic de algoritmul software PCR în timp real.
Semnal reporter
Semnalul reporter se referă la semnalul fluorescent generat de SYBR Green sau de sondele specifice secvenței marcate fluorescent în timpul PCR în timp real.
Semnal de raportor normalizat (RN)
RN se referă la intensitatea de fluorescență a colorantului raportor împărțită la intensitatea de fluorescență a colorantului de referință pasiv măsurată la fiecare ciclu.
Colorant pasiv de referință
În unele PCR în timp real,colorantul fluorescent ROX este folosit ca referință internă pentru a normaliza semnalul fluorescent.Corectează variațiile datorate pipetării inexacte, poziției puțului și fluctuațiilor de fluorescență, în funcție de godeu.
Pragul de fluorescență (pragul)
a fost ajustată peste valoarea de fond și semnificativ sub valoarea de platou a curbei de amplificare.Acesta trebuie să se afle în regiunea liniară a curbei de amplificare, reprezentând intervalul log-liniar de detecție PCR.Pragurile ar trebui stabilite în vizualizarea curbei de amplificare log, astfel încât faza log-liniară a PCR să fie ușor de identificat.Dacă există mai multe gene țintă în PCR în timp real, pragul trebuie setat pentru fiecare țintă.În general, semnalul de fluorescență al primelor 15 cicluri de reacție PCR este utilizat ca semnal de fond de fluorescență, iar pragul de fluorescență este de 10 ori deviația standard a semnalului de fluorescență din primele 3 până la 15 cicluri de PCR, iar pragul de fluorescență este setat în faza exponențială de amplificare a PCR.În general, fiecare instrument are pragul de fluorescență setat înainte de utilizare.
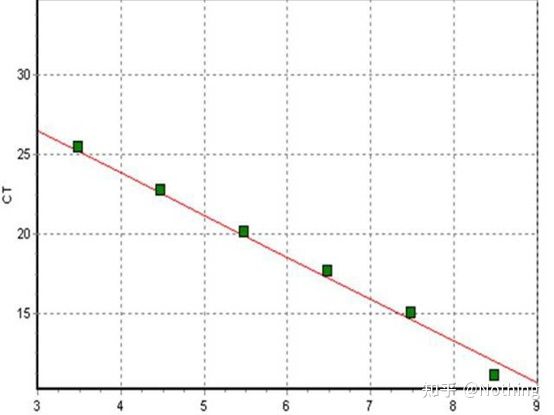
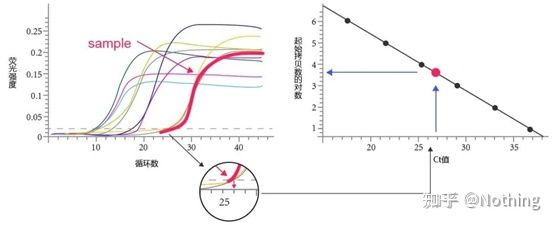
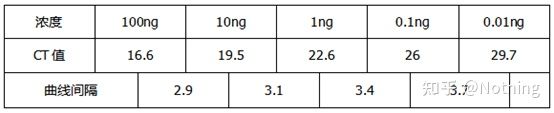
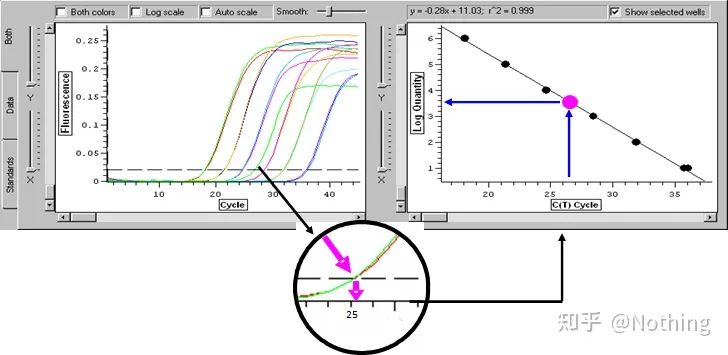
Pragul ciclului (CT) sau Punct de trecere (CP)
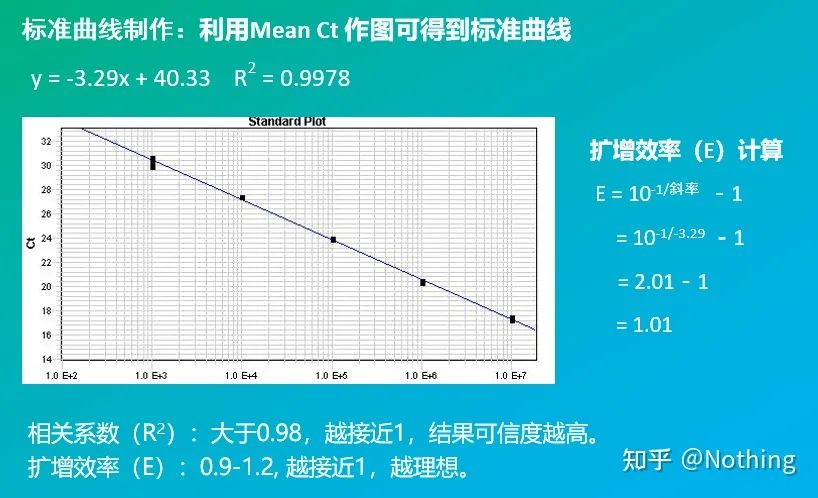
Ciclul la care curba de amplificare depășește pragul (adică punctul în care detecția fluorescenței crește semnificativ).CT poate fi o fracțiune și cantitatea de șablon de pornire poate fi calculată.Valoarea CT reprezintă numărul de cicluri experimentate când semnalul fluorescent din fiecare tub de reacție PCR atinge pragul setat.Există o relație liniară între valoarea CT a fiecărui șablon și logaritmul numărului de copiere inițială a șablonului,mai mare este numărul inițial al copiei, cu atât valoarea CT este mai mică și invers.O curbă standard poate fi realizată utilizând un standard cu număr de copie inițial cunoscut, în care abscisa reprezintă valoarea CT, iar ordonata reprezintă logaritmul numărului de copiere inițială.Prin urmare, atâta timp cât se obține valoarea CT a probei necunoscute, numărul inițial de copiere al probei poate fi calculat din curba standard.
Valoarea ΔCT
Valoarea ΔCT descriediferența dintre gena țintă și valoarea CT a genei de referință endogene corespunzătoare, cum ar fi o genă de menaj și este utilizat pentru a normaliza cantitatea de șablon utilizată:
⇒ΔCT = CT (genă țintă) – CT (genă de referință endogenă)
Valoarea ΔΔCT
Valoarea ΔΔCT descrie diferența dintre valoarea medie ΔΔCT a unei probe de interes (de exemplu, celule stimulate) și valoarea medie ΔΔCT a unei probe de referință (de exemplu, celule nestimulate).Eșantionul de referință este numit și eșantion de calibrare și toate celelalte probe sunt normalizate la aceasta pentru cuantificare relativă:
⇒ΔΔCT = ΔCT mediu (eșantion de interes) – ΔCT mediu (eșantion de referință)
Gene endogene de referință (gene endogene de referință)
Nivelurile de expresie ale genelor endogene de referință, cum ar fi genele menajere (genele menajere), nu diferă între eșantioane.Compararea valorilor CT ale genei de referință cu gena țintă permite ca nivelul de expresie al genei țintă să fie normalizat la cantitatea de ARN de intrare sau ADNc (vezi secțiunea despre valorile ΔCT de mai sus).
Genele de referință interne corecte pentruposibila degradare a ARN sau prezența inhibitorilor enzimatici în probele de ARN, precum și variații ale conținutului de ARN, eficiența transcripției inverse, recuperarea acidului nucleic și manipularea probei.Pentru a selecta gena(ele) de referință optimă, am modificat algoritmul pentru a permite selectarea acesteia a referinței optime în funcție de setarea experimentală.
Control intern
O secvență de control care este amplificată în aceeași reacție ca și secvența țintă și sondată cu o sondă diferită (adică, efectuând PCR duplex).Controalele interne sunt adesea folosite pentru a exclude amplificările eșuate, cum ar fi atunci când secvența țintă nu este detectată.
Probă de calibrare
O probă de referință (de exemplu, ARN purificat dintr-o linie celulară sau țesut) utilizată în cuantificare relativă pentru a compara toate celelalte probe pentru a determina nivelul relativ de expresie al unei gene.Proba de calibrare poate fi orice probă, dar este de obicei un control (de exemplu, o probă netratată sau o probă de la momentul zero al experimentului).
Controale pozitive
utilizați reacții de control cucantități cunoscute de șablon.Controale pozitive sunt adesea folosite pentru a verifica dacă un set de primer sau un set de primer-sondă funcționează corect și că reacția este configurată corect.
Fără control al șablonului (NTC)
O reacție de control care conține toate componentele necesare ale reacției de amplificare, cu excepția șablonului, care este de obicei înlocuit cu apă.Utilizarea NTC poate găsi contaminarea cauzată de contaminarea cu reactiv sau ADN străin, asigurând astfel autenticitatea și fiabilitatea datelor de detecție.Amplificarea controlului NTC indică contaminare.
Fără control RT (NRT)
Procesul de extracție a ARN poate conține ADN genomic rezidual, care este extrem de dăunător și este vinovatul care afectează calitatea datelor și inamicul natural al qPCR, așa că atunci când se proiectează experimente, acesta trebuie să fie proiectat doar pentru a amplifica detectarea ARN.Există două moduri, una este de a proiecta primeri peste introni, cealaltă este de a elimina complet ADN-ul, care dintre ele este mai bună, care va fi discutată mai târziu.Controlul NTR este o oglindă magică pentru a detecta poluarea ADN-ului.Dacă există amplificare, înseamnă că există poluare.
Standarde
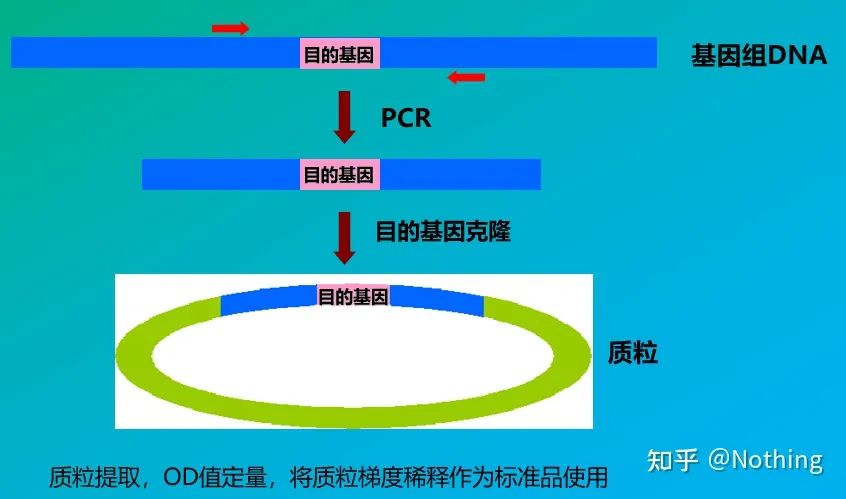
Standardele sunt eșantioane de concentrație cunoscută sau număr de copii care sunt utilizate pentru a construi o curbă standard.Pentru a asigura stabilitatea standardului, fragmentul de genă este de obicei donat în plasmidă și utilizat ca standard.
Curba standard
este de obicei diluat în cel puțin 5 gradienți de concentrație cu produsul standard în funcție de raportul de dublare, iar 5 puncte sunt desenate în coordonatele valorii CT și ale numărului de copii, iar punctele sunt conectate pentru a forma o linie pentru a genera o curbă standard.Pentru fiecare curbă standard, validitatea acesteia trebuie verificată.Valoarea pantei se încadrează între –3,3 și –3,8, iar fiecare concentrație se efectuează în trei exemplare.Punctele care sunt semnificativ diferite de alte puncte ar trebui eliminate.Valoarea CT a probei de testat este adusă în curba standard, iar nivelul de expresie al probei de testat poate fi calculat.
Valoarea CT a probei de testat este adusă în curba standard și poate fi calculat numărul inițial al exemplarului de testat.
Eficiență și pantă
Panta curbei standard reprezintă eficiența PCR în timp real.
·O pantă de -3,322 indică faptul că eficiența de amplificare PCR este de 1 sau 100% eficientă, iar cantitatea de produs PCR se dublează la fiecare ciclu.
·O pantă mai mică de –3,322 (de exemplu, –3,8) indică o eficiență PCR
·O pantă mai mare de –3,322 (de exemplu, –3,0) indică faptul că eficiența PCR pare a fi mai mare de 100%, ceea ce este curios, cum ar putea un ciclu de PCR să genereze mai mult de dublu produsul amplificat?Această situație apare în faza neliniară a reacției PCR, adică există o cantitate mare de amplificare nespecifică.
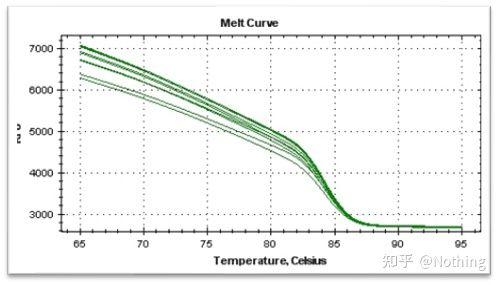
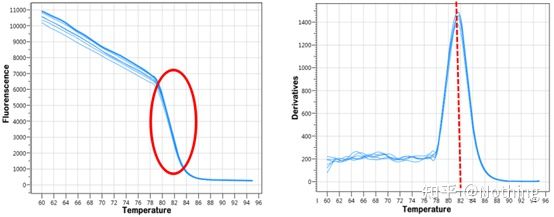
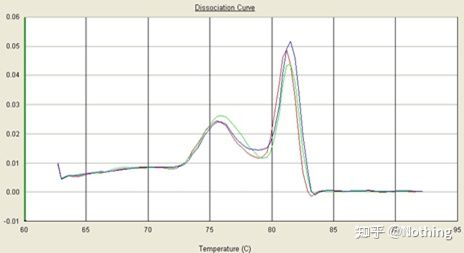
curba de topire
După ce amplificarea qPCR este finalizată, produsul PCR este încălzit.Pe măsură ce temperatura crește, produsul de amplificare dublu catenar se topește treptat, rezultând o scădere a intensității fluorescenței.Când se atinge o anumită temperatură (Tm), un număr mare de produse se vor topi.Fluorescența scade brusc.Diferite produse PCR au valori Tm diferite și temperaturi de topire diferite, astfel încât specificitatea PCR poate fi identificată.
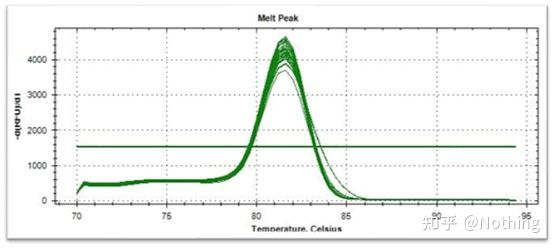
Curba de topire (curba derivata)
Curba de topire este derivată pentru a forma o hartă a vârfurilor, care poate afișa mai intuitiv situația fragmentelor de produs PCR.Deoarece temperatura de topire este valoarea Tm a fragmentului de ADN, unii parametri care afectează valoarea Tm a fragmentului de ADN pot fi apreciați, cum ar fi dimensiunea fragmentului, conținutul de GC etc. În general, conform principiilor noastre de proiectare a primerului,lungimea produsului amplificat este în intervalul 80-300bp, deci temperatura de topire ar trebui să fie între 80°C și 90°C.
Interpretarea curbei de topire: Dacă singurul vârf principal apare între 80°C-90°C, înseamnă că PCR-ul cantitativ fluorescent este perfect;dacă vârful principal apare între 80°C-90°C și vârfurile diverse apar sub 80°C, se ia în considerare practic dimerul de amorsare.Puteți încerca să creșteți temperatura de recoacere pentru a o rezolva;dacă vârful principal apare între 80°C-90°C, iar vârful divers apare din nou când temperatura crește, practic se consideră că există contaminare cu ADN, iar ADN-ul trebuie îndepărtat în etapa inițială a experimentului.
Desigur, există încă câteva situații anormale, care vor fi defalcate una câte una mai jos.
3. Cunoștințe avansate
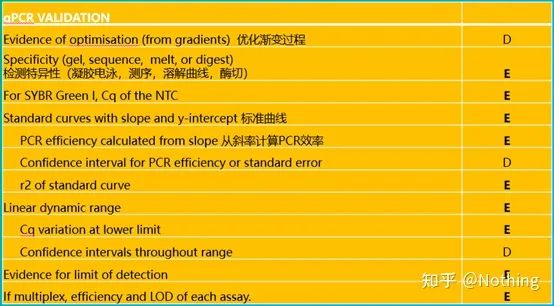
Pentru a face qPCR, trebuie să spun MIQE,Informații minimepentru Publicarea deCantitativPCR în timp realExperimente — informațiile minime pentru publicarea articolelor despre PCR cantitativ în timp realexperimente .Pentru a simplifica înțelegerea tuturor, vom simplifica conținutul cheie.
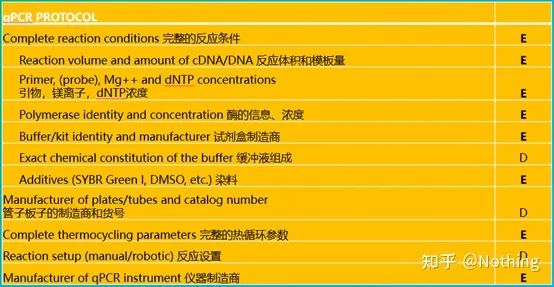
Puteți căuta textul original al MIQE pe Internet, iar cel mai important lucru este că acesta prevedelista de verificare a datelor care trebuie furnizată la publicarea unui articol .
Recenziatorii pot judeca calitatea experimentului citind aceste detalii;viitorii cititori îl pot folosi și pentru a repeta sau a îmbunătăți experimentul.
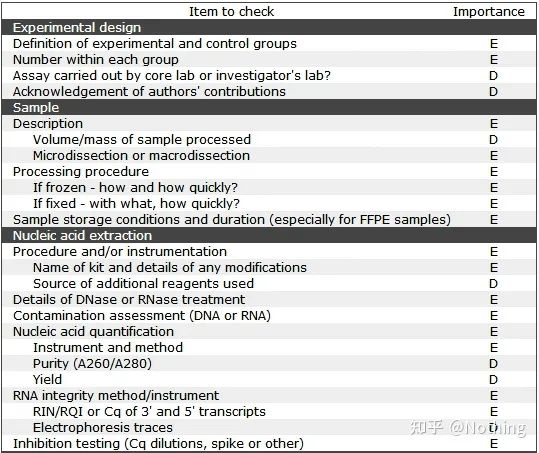
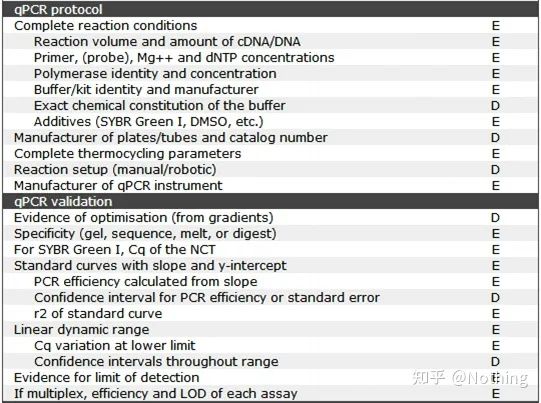
Este de remarcat faptul că în această listă, importanța fiecărei liste este marcată cu E sau respectiv D.Ce înseamnă?E: informații esențiale (trebuie depuse);D: informații de dorit (oferiți cât mai multe).
MIQE (1) — Proiectare experimentală
Mulți ticăloși care și-au încheiat apărarea după ce și-au terminat studiile postuniversitare nu vor ști să conceapă un experiment în mod independent, să-și deschidă caietele și să facă ceea ce le spune profesorul.Drept urmare, designul experimental nu a fost riguros, iar departamentul editorial al revistei a spus că vor să alcătuiască această poză și acea poză, așa că au făcut-o năuciți.Așa se fac ticăloșii!
Mai aproape de casă, primul principiu al experimentului este de a determinarigoarea logicii experimentale.Cel mai fundamental lucru este designul experimental, iar cel mai important lucru despre proiectul experimental este modul de setare a eșantionului țintă, a eșantionului de referință (de control) și a numărului de repetări, astfel încât datele experimentale să poată fi referite, comparabile și convingătoare.
Eșantionul țintăse referă la proba care ne cere să detectăm gena țintă după un anumit tratament.Eșantionul de referințăeste eșantionul fără niciun tratament, care este adesea denumit tip sălbatic în biologie.
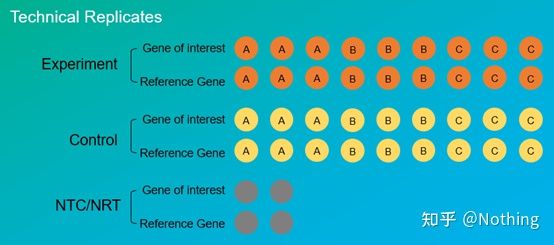
Replica experimentalesunt foarte importante.În general, numărul de replici persuasive trebuie să fie mai mare de trei.Este necesar să distingem ce este replicarea biologică și ce este replicarea tehnică.
Replicate biologice: Același experiment de verificare făcut cu diferite materiale (timp, plante, loturi, plăci de reacție).
Dublare biologică
Să luăm ca exemplu tratamentul cu pesticide al ardeiului.Vrem să pulverizăm pesticide pe cele trei plante ale ABC, apoi cele trei plante ale ABC sunt trei replici biologice și sunt același experiment de verificare efectuat cu materiale diferite.Dar ca experiment, este cu siguranță nevoie de un control, așa că putem pulveriza una dintre ramurile plantei A pentru a forma un grup experimental de planta A și nu pulverizam celelalte ramuri ale plantei A pentru a forma un grup de control.Faceți același lucru pentru B și C.
Replicate tehnice (Replicate tehnice): Este un experiment repetat conceput pentru a evita erorile cauzate de operare, care este de fapt o gaură duplicat inclusă în același material.Atât tratamentele, cât și controalele trebuie să aibă setări replicate (minimum trei) ale genei țintă și ale genei de referință internă.
Repetarea tehnică
Luați din nou ca exemplu ardeiul tratat cu pesticide.Pentru grupul experimental al plantei A, am făcut trei găuri PCR de 1, 2 și 3 pentru gena țintă și respectiv gena de referință internă, astfel încât să luăm media după detectare.Pentru controlul plantei A Grupurile sunt de asemenea tratate în același mod.În mod similar, faceți același tratament pentru plantele B și C.Aceasta este repetiție tehnică.
Este demn de remarcat faptul căceea ce intră în statistică este repetarea biologică, iar repetarea tehnică este de a testa dacă există fenomene aleatorii în procesul experimental, astfel încât rezultatele experimentale să fie credibile, adică pentru a evita erorile luând media lor, așa cum spunem adesea.
Controale negative - NTC și NRT
NTC (control fără șablon), un control fără șablon, este utilizat pentru a verifica dacă materialul experimental este contaminat.În general, apa este folosită ca șablon.Dacă există o reacție fluorescentă, aceasta indică faptul că a avut loc contaminarea cu acid nucleic în laborator.
Aceste poluări provin din: apă impură, reactivi necalificați care conțin ADN endogen, poluarea primerului, poluarea echipamentelor de laborator, poluarea cu aerosoli, etc., necesitatea de a folosi captatori de RNază și inhibitori de RNază.Poluarea cu aerosoli este cea mai dificil de găsit.Imaginează-ți că laboratorul tău este ca smogul, cu diverși acizi nucleici suspendați în aer.
NRT (fără transcriptază inversă), controlul fără transcripție inversă, este ARN-ul transcris non-revers ca control negativ, care este controlul restului de ADNg.
Când se face expresia genelor, cantitatea de ARN este detectată prin detectarea cantității de ADNc după transcrierea inversă.Dacă există reziduuri de ADNg atunci când ARN-ul este purificat, va cauza erori în rezultatele experimentale, deoarece rezultatele efective obținute sunt ADNg și ADNc.La nivel agregat, nu doar ADNc, ADNg trebuie să fie complet îndepărtat în timpul extracției ARN.
MIQE (2) - eșantion de informații
Așa-numita informație eșantion înseamnă că atunci când publicăm un articol despre qPCR, trebuie să explicăm în mod clar informațiile eșantionului, care este o parte indispensabilă a articolului.În mod similar, atunci când procesăm mostre, trebuie să ne reglementăm și propriile operațiuni pentru a asigura validitatea probelor.
Descrierea probei este doar un rezultat și ar trebui să acordăm mai multă atenție materialelor luate pe parcursul întregului experiment.
Selectarea materialelor experimentale
Probe de sânge – alegeți sânge proaspăt, nu mai mult de 4 ore.Probe de celule – alegeți să colectați celule proaspete într-o perioadă de creștere viguroasă.Țesut animal—Alegeți țesut proaspăt, cu creștere viguroasă.Țesut vegetal – Alegeți țesut proaspăt, tânăr.
Trebuie să fi observat că în aceste câteva propoziții există un cuvânt cheie: fresh .
Pentru mostrele de mai sus, cel mai bun kit, rentabil și stabil de pe piață este kitul Foregene, care își poate extrage rapid și ușor ADN-ul și ARN-ul.
Kit de izolare a ARN total al celulelor
Kit de izolare a ARN total animal
Kit de izolare a ARN total al plantelor
Kit de izolare a ARN total al plantelor Plus
Depozitarea materialelor experimentale
În general, nu recomandăm păstrarea probelor, dacă condițiile permit.Cu toate acestea, există mulți prieteni care nu pot efectua experimente imediat după prelevare și unii chiar trebuie să transporte rezervoare de azot lichid pe teren pentru prelevare.
Pentru acest tip de prieten harnic, pot spune doar că nu înțelegeți consumabilele de reactivi.Acum multe companii de consumabile de reactivi produc reactivi care pot stoca probe de ARN la temperatura camerei și puteți alege să le utilizați.Metoda convențională de depozitare este stocarea azotului lichid, folosind un rezervor mic de azot lichid care este ușor de transportat.După ce ați adus proba înapoi în laborator, păstrați-o la frigider -80°C.
Pentru experimentele care implică ARN, trebuie urmat principiul celor șase cuvinte:temperatură scăzută, fără enzime,șirapid .
Conceptul de temperatură scăzută este ușor de înțeles;fără enzime, RNaza este peste tot în lumea în care trăim (altfel ai fi fost ucis de HIV), așa că cum să eviți RNaza atunci când faci experimente este un concept foarte important;rapid,Nu există Kung Fu în lume care să nu poată fi rupt, doar viteza să nu poată fi ruptă.
Prin urmare, într-un fel, cu cât timpul de extracție este mai scurt, cu atât trusa este mai bună.De ceForegeneSetul lui pune accent pe viteza, pentru că o știu bine.
PS: Unele fete fac experimente foarte atent, dar nu sunt la fel de bune ca un slam dunk după câțiva ani de muncă.Ei simt că Dumnezeu este nedrept, se plânge de alții și își caută viața.De fapt, ea nu a înțeles.Nu a protejat bine ARN-ul, iar jucătorul de slam dunk era agil.Când făcea experimentul, s-a gândit că va termina slam dunk-ul cu trei ori, cinci ori și două divizii, dar a făcut experimentul bine.
Notă: Mai lent, mai multe șanse de invazie cu RNază.Cum să te antrenezi să fii rapid?Nu există cum, doar exersează mai mult.
Pentru diferite experimente și probe diferite, este încă necesar să citiți mai multă literatură și să alegeți o metodă adecvată de procesare.Pentru procesul de colectare și stocare a probelor, MIQE cere ca acesta să fie scris în mod clar în lucrare, astfel încât recenzenții să poată revizui fiabilitatea lucrării și, de asemenea, este convenabil pentru tinerii uimiți să repete experimentul.
Deși experimentele biologice sunt dificile, sunt de ultimă generație.Dacă nu ești atent, poți răsturna lumea.De exemplu, transformarea SARS într-o criză biochimică sau fabricarea de orez hibrid pentru a salva 1,3 miliarde de oameni.Imaginea de mai jos este un experiment chimic, ar trebui să înțelegeți cât de mândru sunteți de cercetarea dvs. doar uitându-vă la aspectul său asemănător penisului.Uită, nu-l înnegri.
MIQE (3) – extracția acidului nucleic.
Extracția acidului nucleic este un eveniment mare, iar toate experimentele de biologie moleculară încep cu extracția acidului nucleic.În primul rând, să copiem conținutul MIQE despre extracția acidului nucleic.
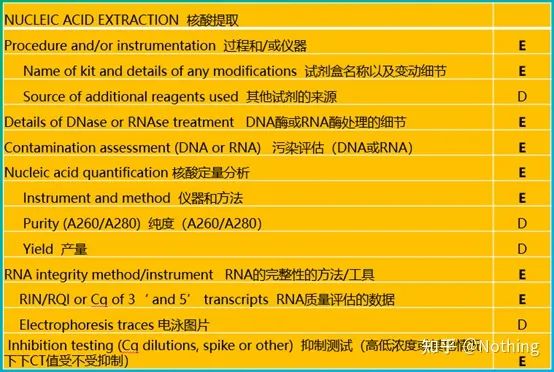
Privind această formă, nu poți rămâne la suprafață.Forma este o dogmă.Pentru a fi un student de top, trebuie să întrebi de ce.Conținutul esențial al acestui tabel este: Urmărirepuritatea, integritatea, consistența și cantitatea de extracție a ARN .
Prima parte aprocedeul sau instrumentul este etapa de extracție a acidului nucleic.Dacă utilizați un extractor automat de acid nucleic pentru a extrage (avansat, vă rugăm să mă contactați pentru achiziție), trebuie să indicați numele modelului instrumentului.
Numele trusei și
Ce trusă a fost folosită pentru detaliile modificării, ce reactivi speciali au fost adăugați sau ce operațiuni speciale au fost efectuate trebuie explicate clar, astfel încât alții să poată repeta cu ușurință experimentul dvs.
Unii oameni adaugă niște reactivi speciali atunci când extrag probe speciale, crezând că aceasta este arma lor secretă și nu spun altora.Deși păstrează secretul, ei pierd și oportunitatea de a vă face articolul să strălucească.Nu fi deștept, trebuie să fii mai sincer decât bătrânul Zhang în cercetare științifică, dacă vrei să fii deștept, articolul te va face prost.
trebuie să vă amintiți numărul de produs al kit-uluicand comandati kitul si scrieti articolul .În general, pe kit există două numere: Cat—număr de catalog (numărul produsului, numărul articolului), Lot—numărul lotului produsului (utilizat pentru a indica din ce lot provine produsul).
În plus, numărul CAS este adesea folosit când se comandă reactivi biochimici și îl voi populariza împreună.Numărul CAS este numărul dat de American Chemical Society fiecărui medicament chimic nou.În general, trei numere sunt conectate printr-o liniuță.Numărul CAS al lui Rushui: 7732-18-5.Produsele chimice au adesea pseudonime multiple, dar numărul CAS este unic.Când comandați un medicament, puteți verifica mai întâi numărul CAS al acestuia.
Mai aproape de casă, de ce trebuie să descriem aceste lucruri clar?De fapt, este și pentru a verifica calitatea extracției ARN.Utilizarea instrumentelor și truselor va face extracția ARN-ului mai consistentă.Scara de extracție a laboratoarelor obișnuite nu este mare și poate fi obținută cu truse.
Detaliile tratamentului cu DNază sau RNază
Problema importantă a PCR cantitativ fluorescent este prevenirea contaminării ADN și nu experimentați dacă există contaminare.Prin urmare, este imperativ să precizați procesul pe care l-ați folosit pentru a procesa ADN-ul, pentru a demonstra că ADN-ul din procesul experimental a fost complet și complet îndepărtat.reprezentată printr-o diagramă schematică.
Schema schematică a ARN-ului și ADN-ului
În general, metoda de îndepărtare a ADN-ului este tratarea ARN-ului cu DNază după extracție.Cu toate acestea, acestea sunt metode relativ vechi.Trusele comerciale de extracție a ARN au fost capabile să elimine ADN-ul în timpul procesului de extracție fără a adăuga DNază.De exemplu, o serie de truse de la Foregene.
Notă: Eliminarea ADN-ului în timpul extracției ARN este o sabie cu două tăișuri foarte periculoasă, care va prelungi timpul de operare al extracției ARN-ului și va crește riscul de degradare a ARN-ului.Practic, este un compromis între randamentul ARN și puritate.
În plus, cantitatea de DNază adăugată la coloana de adsorbție pe bază de silice este foarte mică și trebuie utilizată DNază de înaltă calitate pentru a obține efectul.DNaza neoptimizată nu poate fi digerată rapid și complet.Acesta este un test al nivelului tehnic al comerciantului.Desigur, există și mai mulți negustori ciudați care se laudă că ADN-ul poate fi îndepărtat fără DNază.Se poate spune că oricine se laudă că ADN-ul poate fi îndepărtat complet fără DNază este un huligan.ADN-ul este o structură dublu catenară relativ stabilă și nu poate fi șters doar vorbind și râzând.
Evaluarea contaminării
metoda de evaluare: detecție electroforeză, 1% agaroză, 6V/cm, 15min, încărcare 1-3 ul
Analiza cantitativă a acidului nucleic
se măsoară de obicei folosind un spectrofotometru UV.Permiteți-mi mai întâi să popularizez sensul celor trei valori ale OD260, OD280 și OD230.
·OD260nm: este lungimea de undă de absorbție a celui mai mare vârf de absorbție al acidului nucleic, iar cea mai bună valoare măsurată variază de la 0,1 la 1,0.În caz contrar, diluați sau concentrați proba pentru a o aduce în interval.
·OD280nm: Este lungimea de undă de absorbție a celui mai mare vârf de absorbție al proteinelor și substanțelor fenolice.
·OD230nm: Este lungimea de undă de absorbție a celui mai mare vârf de absorbție al carbohidraților.
În continuare, să vorbim despre rolul fiecărui indicator.Pentru A260, poate fi utilizat pentru a măsura randamentul de acid nucleic.Când OD260=1, dsDNA=50μg/ml, ssDNA=37μg/ml, ARN=40μg/ml.
Pentru puritate, trebuie să ne uităm la rapoartele pe care le vedem în mod obișnuit: OD260/280 și OD260/230.
·ADN pur: OD260/280 este aproximativ egal cu 1,8.Când este mai mare de 1,9, indică că există poluare cu ARN, iar când este mai mică de 1,6, indică că există poluare cu proteine și fenol.
·ARN pur: 1,7
·OD260/230: Indiferent dacă este vorba de ADN sau ARN, valoarea de referință este 2,5.Când este mai mică de 2,0, indică faptul că există poluare cu zahăr, sare și materie organică.
Integritatea ARN
Este foarte important să se măsoare integritatea ARN-ului.În general, este necesar să se facă un experiment cu gel de denaturare a ARN pentru a verifica dacă luminozitatea dintre ARN-ul 28S și 18S este o relație dublă.Când apare a treia bandă 5S, înseamnă că ARN-ul a început să se degradeze, cu excepția nevertebratelor.
Date pentru evaluarea calității ARN: Pe lângă testele de mai sus, există și câteva teste instrumentale mai avansate în ceea ce privește integritatea ARN, cum ar fi testul de integritate RQI al sistemului automat de electroforeză Experion, care poate detecta dacă ARN-ul este degradat invizibil.
În cercetarea științifică, PCR cantitativ fluorescent este o comparație între gena țintă și gena de referință internă.Prin urmare, în procesul de conservare a probei de ARN, extragerea ARN etc., scopul principal este de a asigura integritatea ARN-ului.
Modul în care integritatea ARN-ului afectează echilibrul dintre gena țintă și gena de referință internă poate fi ușor de înțeles din figura de mai jos.Degradarea va duce la incompletitudinea genei, fie că este vorba de incompletitudinea genei interne de referință sau de incompletitatea genei țintă, va avea un impact mare asupra datelor.
Diagrama schematică a genei țintă și a genei de referință nu trebuie să fie adevărată
Test de inhibiție (dacă valoarea CT este suprimată în concentrație mare sau scăzută sau în alte condiții)
Luând această figură ca exemplu, valorile Ct ale celor cinci curbe sunt după cum urmează.Distribuția valorilor CT între curbe este neuniformă, iar valorile Ct sunt întârziate la concentrații mari și scăzute, ceea ce este cazul inhibării PCR.
Punct cheie: În procesul de extracție a ARN-ului, trebuie să renunțăm la concepțiile greșite și să stabilim unele corecte.
Ideea greșită este: extracția de ARN urmărește doar randamentul, gândindu-se că cu cât cantitatea de ARN obținută este mai mare, cu atât mai bine.De fapt, atunci când facem cuantificare, dacă numărul de gene nu este foarte mare, nu avem nevoie de mult ARN.Cantitatea de ARN pe care o extrageți este mai mult decât suficientă.
Conceptul corect este:Extracția ARN ar trebui să urmărească puritatea, integritatea și consistența.Puritatea poate asigura că transcrierea inversă ulterioară nu este inhibată și că datele nu vor fi afectate de ADN.Integritatea asigură echilibrul dintre secvențele țintă și referințele interne.Consecvența asigură o încărcare stabilă a probei.
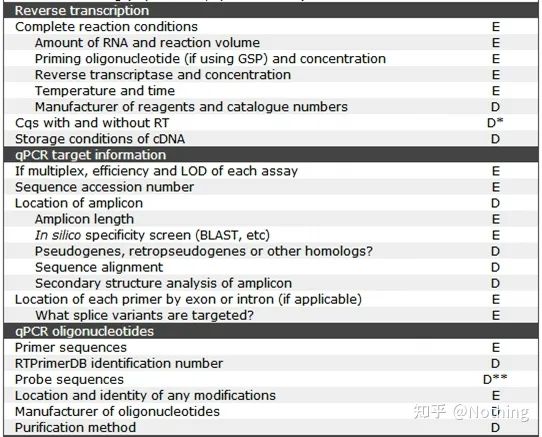
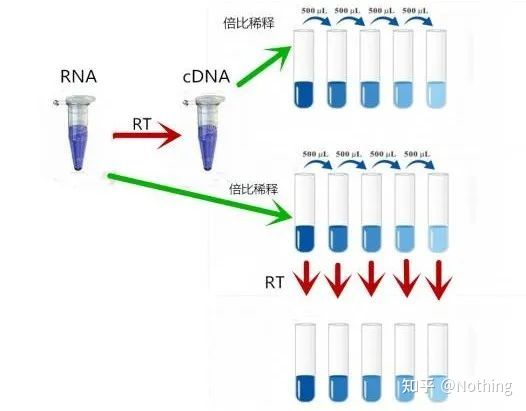
MIQE (4) – transcriere inversă
Concepție greșită: urmărirea unui volum mai mare de probă.
Concept corect: Urmărește consistența (stabilitatea), indiferent de cantitatea de ARN încărcat, eficiența transcripției inverse rămâne consecventă, asigurându-se că diferențele de ADNc pot reflecta cu adevărat diferențele de ARNm.
Explicăm acest proces cu o diagramă schematică:
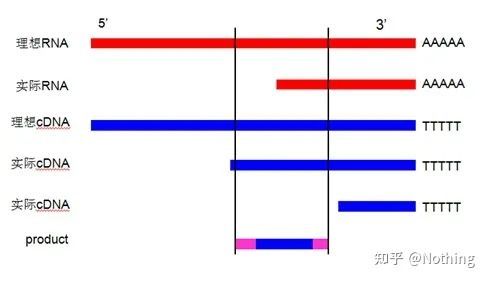
Diagrama schematică a eficienței transcripției inverse, nu este adevărată
În primul rând, trebuie să înțelegem diferența dintre procesul de transcriere inversă și procesul PCR.PCR suferă multiple procese de încălzire și recoacere, iar fragmentul țintă crește exponențial;în timp ce transcripția inversă nu are acest proces, ne putem imagina că transcrierea inversă este de fapt unu-la-unu În timpul procesului de replicare, cât mai multe bucăți de ARN
pe cât există pot obține cât mai multe bucăți de informații despre ADNc, ar trebui să fie înțeles până acum, deoarece fragmentele mari și mici au fost transcrise invers și este imposibil să se concentreze asupra unui singur fragment.Și pentru că cantitatea de ARN este relativ mică, cantitatea de ADNc obținută este și ea relativ mică, spre deosebire de PCR, care are efect de amplificare, deci practic este imposibil de detectat.
Rezultatele electroforezei cADN
În al doilea rând, în mod ideal, transcripția inversă este efectuată unu la unu, dar nicio transcriptază inversă de la nicio companie nu poate obține acest efect.Practic, eficiența majorității transcriptazelor inverse rătăcește între 30-50%.Dacă acesta este cazul, am avea mai degrabă o eficiență de transcripție inversă relativ stabilă, ceea ce dorim să vedem în figură: 3 ARN obțin 2 ADNc, 6 ARN primesc 4 ADNc, deci indiferent cât de multă probă este încărcată, eficiența transcripției inverse este relativ stabilă.Nu vrem să vedem situația în care eficiența transcripției inverse este instabilă și concentrația mare este inhibată.
Deci, cum se verifică dacă eficiența transcripției inverse este stabilă?Metoda este foarte simplă, trebuie doar să faceți un test de comparație: unul este să transcrieți invers în ADNc după dublarea diluției ARN, iar celălalt este să faceți o diluție dublată după transcrierea inversă în ADNc și apoi să faceți qPCR pentru a vedea panta obținută Este consecvent.Ca student de top, ar trebui să înțelegi în câteva secunde.Așa cum se arată mai jos:
Diluarea ARN și ADNc pentru a testa dacă eficiența transcripției inverse este stabilă
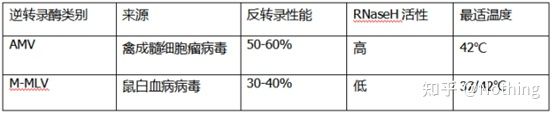
Reverse transcriptază și kit
Cum poate PCR cantitativ fluorescent perfect să aibă reverse transcriptază și kit excelente.Reverse transcriptaza este împărțită aproximativ în două tipuri în funcție de sursă, AMV sauM-MLV, iar performanța lor este aceeași cu cea prezentată în tabel.
Activitatea RNază H
RNaza H este Ribonucleaza H, numele chinezesc este ribonucleaza H, care este o endoribonuclează care poate hidroliza în mod specific ARN-ul în lanțul hibrid ADN-ARN.RNaza H nu poate hidroliza legăturile fosfodiester în ADN sau ARN monocatenar sau dublu catenar, adică nu poate digera ADN sau ARN monocatenar sau dublu catenar.Utilizat în mod obișnuit în sinteza celei de-a doua catene de ADNc.
E un lucru ciudat.Spunem că transcriptaza inversă are activitate RNaza H, nu că transcriptaza inversă conține RNază H și s-ar putea să nu fie posibilă separarea RNază H de transcriptază inversă, poate din cauza conformării anumitor grupuri în transcriptază inversă. Această activitate este cauzată de transcriptază inversă.
Prin urmare, indiferent de eficiența mai mare a transcripției inverse a AMV, activitatea sa RNază H reduce randamentul de ADNc.Desigur, producătorii de reactivi își optimizează în mod constant produsele pentru a elimina activitatea RNazei H în transcriptază inversă cât mai mult posibil pentru a crește randamentul de ADNc.
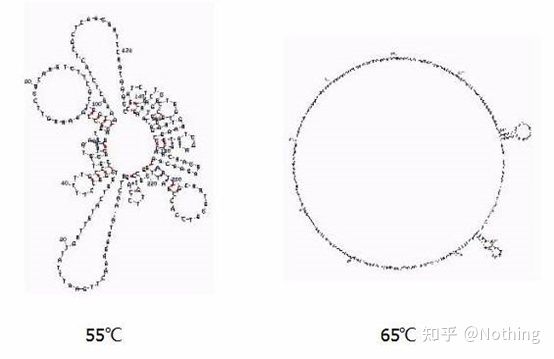
Temperatura de recoacere
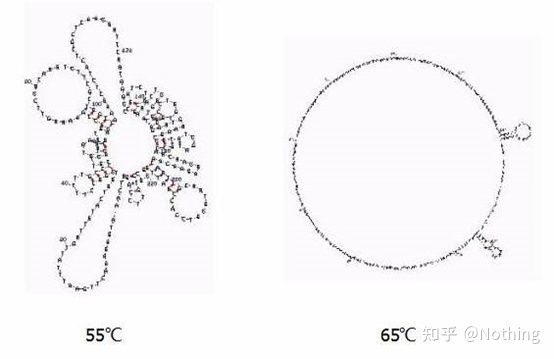
Structura secundară a ARN-ului la diferite temperaturi
Consultați figura de mai sus pentru structura secundară a ARN-ului la diferite temperaturi și utilizați instrumentul online mFold pentru a determina structura secundară a fragmentului țintă în condiții specifice de temperatură și concentrație de sare.La 55°C, structura secundară a ARN-ului este încă foarte complexă, transcriptaza inversă nu poate funcționa, iar structura secundară nu poate fi rezolvată complet până la 65°C, în timp ce temperatura optimă a AMV și M-MLV este mult mai mică decât această temperatură.
ce să fac?Structura secundară este împerecherea complementară a șablonului în sine, ceea ce duce la o competiție puternică între primer și transcriptază inversă și șablon, rezultând o serie de probleme precum E scăzut și repetabilitate slabă.
ce să fac?Creșteți doar temperatura de recoacere cât mai mult posibil.
Mulți producători de reactivi își îmbunătățesc transcriptaza inversă prin inginerie genetică.Unele cresc temperatura de reacție, cum ar fi Jifan și Aidelai, iar altele elimină grupul activ al enzimei RNază H pentru a îmbunătăți afinitatea dintre enzimă și matrița ARN.Afinitatea ridicată poate stoarce în mod competitiv structura secundară și poate citi fără probleme și, de asemenea, poate îmbunătăți considerabil eficiența transcripției inverse.
Punct cheie: transcrierea inversă este mai importantă pentru a urmări consistența eficienței transcripției inverse (enzimele trebuie să fie nu numai eficiente, ci și stabile), mai degrabă decât cantitatea de probă încărcată, dacă nu este o PCR cantitativă fluorescentă deosebit de mare, nu va fi posibil deloc.ADNc multiple.
Diferiți producători au făcut, de asemenea, unele eforturi în căutarea consecvenței.De exemplu, majoritatea companiilor au ambalat acum transcrierea inversă ca un kit standard de vânzare, ceea ce este o alegere bună.
De exemplu, kiturile din seria RT Easy de la Foregene:
RT Easy I (Preamestec principal pentru trusa de sinteză a ADNc-ului prima catena)
MIQE (5) – informații despre gena țintă
Figura de mai sus explică
1. Dacă această genă este eficientă pentru experimente repetate poate fi verificat în general prin experimente repetate.
2. ID-ul genei, știi.
3. Lungimea genei, lungimea totală a genei țintă este cu siguranță nicio problemă.Când proiectați primeri, asigurați-vă că lungimea ampliconului este între 80-200 bp pentru a asigura o eficiență mai bună a amplificării.
4. Informații de comparare a secvenței Blast, gena țintă trebuie comparată în banca de gene pentru a preveni amplificarea nespecifică.
5. Prezența pseudogenelor.O pseudogenă este o secvență de ADN similară cu o genă normală, dar își pierde funcția normală.Adesea există în familia multigenă a eucariotelor.Este de obicei reprezentată prin ψ.Este o copie a ADN-ului genomic nefuncțional din genom, care este foarte asemănătoare cu secvența genei codificatoare., în general nu sunt transcrise și nu au un sens fiziologic clar.
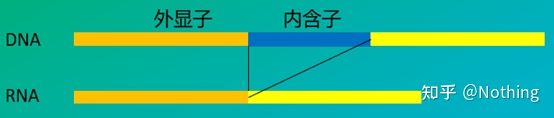
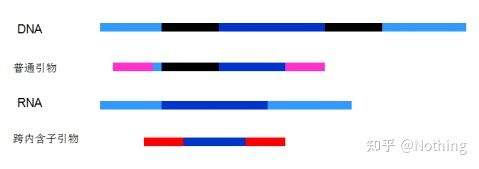
6. Poziția primerilor față de exoni și introni.În primii ani, când am rezolvat problema contaminării ADN-ului, am acordat adesea atenție pozițiilor primerilor, exonilor și intronilor și, în general, am luat în considerare proiectarea primerilor peste introni pentru a evita amplificarea ADN-ului.Vă rugăm să vedeți figura de mai jos: negrul reprezintă intronii, albastrul variat reprezintă exonii, rozul reprezintă primeri obișnuiți, iar roșu strălucitor reprezintă primeri care se întind introni.
Schematic, niciodată adevărat
Ce plan perfect pare, dar de fapt, în cele mai multe cazuri, primerii trans-intron nu sunt atât de magici pe cât s-a imaginat și vor provoca, de asemenea, o amplificare nespecifică.Deci, cel mai bun mod de a preveni contaminarea ADN-ului este eliminarea completă a ADN-ului.
7. Predicția conformației.Folosind din nou acest exemplu, utilizați instrumentul online mFold pentru a determina structura secundară a fragmentului țintă la o anumită temperatură și concentrație de sare.
Structura secundară a ARN-ului la diferite temperaturi
Structura secundară este împerecherea complementară a șablonului în sine, ceea ce va duce la o competiție puternică între împerecherea primer și șablon, iar șansele de legare a primerului sunt mai mici, rezultând o serie de probleme precum E scăzut și repetabilitate slabă.Prin predicția software, dacă nu există nicio problemă de structură secundară, ar fi grozav.Dacă există, articolul nostru de urmărire va discuta în mod specific cum să rezolvi această problemă.
MIQE (6) - oligonucleotide qPCR
Pentru PCR cantitativ fluorescent, primul lucru cu care te lupți în fiecare zi este extracția ARN, iar al doilea lucru poate fi proiectarea primerului.
În primul rând, verificăm în continuare regulile despre proiectarea grundului conform listei de verificare MIQE.Este atât de simplu încât nebunii pot râde și îl putem termina într-o singură propoziție: aflați secvența și poziția sondei de primer și metoda de modificare.Pentru metoda de purificare a primerului, sinteza primerului este atât de ieftină în prezent, qPCR este demn de PAGE și metodele de purificare de mai sus, iar informațiile instrumentului de sinteză nu sunt importante.Mulți oameni au făcut amorse de zeci de ani și nu știu că sintetizatorul este ABI3900.
În ceea ce privește principiile de proiectare a grundurilor, nu trebuie să le memorați prin memorare, deoarece majoritatea softurilor de proiectare a grundurilor sau instrumentelor online se pot ocupa de aceste probleme (instrumentul online recomandat primer3.ut.ee/), iar 99,999% din proiectarea grundurilor nu se face manual Uite, autorul proiectează uneori sute de grunduri pe zi, dacă citești unul câte unul, va deveni încrucișat.
Doar verificați următoarele puncte după ce grundurile sunt proiectate:
1. Proiectați primeri aproape de capătul 3′: în cazul utilizării primerilor oligo dT pentru sinteza primei catene de ADNc, având în vedere eficiența transcripției inverse și integritatea ARN, primerii proiectați trebuie să fie proiectați aproape de capătul 3′ pentru a îmbunătăți eficiența amplificării.Folosiți o imagine pentru a explica după cum urmează (nu există nicio modalitate de a înțelege acest lucru):
De ce ar trebui să fie proiectați grunduri aproape de capătul 3′, nu trebuie să fie adevărat
2. Valoarea TM: Valoarea Tm este la 55-65°C (deoarece activitatea exonucleazei este cea mai mare la 60°C), iar conținutul GC este de 40%-60%.
3. BLAST: Pentru a evita amplificarea nespecifică a genomului, Blast trebuie utilizat pentru verificare suplimentară.
MIQE(7)—proces qPCR
1. kit qPCR
În conformitate cu cerințele MIQE, trebuie să descriem în mod clar condițiile complete de reacție în articol, inclusiv configurația sistemului de reacție PCR, ce kit este utilizat, cine este producătorul, cât de mare este sistemul de reacție, dacă este utilizată metoda colorantului sau metoda sondei, setările programului PCR.Șoferii veterani vor descoperi cu siguranță că atâta timp cât setul este selectat, informațiile de mai sus sunt în principiu determinate.
În prezent, fabricarea și producția de truse PCR cantitative fluorescente este o tehnologie foarte matură.Atâta timp cât nu alegeți producători extrem de răi, probabilitatea apariției problemelor nu este mare, dar dorim totuși să vă împărtășim câteva puncte:
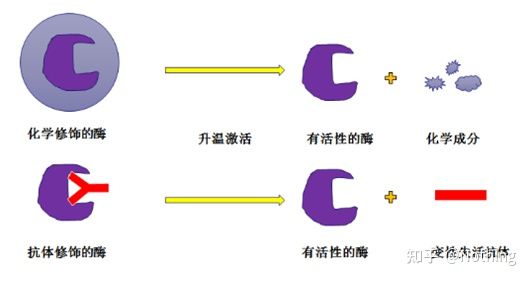
Enzima Taq cu pornire la cald:Cea mai importantă parte a PCR este enzima Taq cu pornire la cald.Enzimele de pornire la cald de pe piață sunt, în general, împărțite în două tipuri, una este o enzimă de pornire la cald modificată chimic (vă puteți imagina ca încorporare de parafină), iar cealaltă este o enzimă de pornire la cald pentru modificarea anticorpilor (legarea antigen-anticorp).Modificarea chimică este o modalitate timpurie de pornire la cald a enzimelor.Când se atinge o anumită temperatură, enzima își va elibera activitatea.Enzima de pornire la cald modificată cu anticorpi utilizează metode biologice pentru a bloca activitatea enzimei.Când se atinge o anumită temperatură, anticorpul va fi denaturat și inactivat ca proteină, iar activitatea enzimatică va fi adusă în joc.
Totuși, la ce folosește acest lucru?Acesta este cazul, activitatea de eliberare a enzimelor modificate cu anticorpi este mai rapidă decât cea a enzimelor modificate chimic, deci din punct de vedere al sensibilității, enzimele modificate cu anticorpi au un ușor avantaj, astfel că practic nu există enzime modificate chimic în trusele de pe piață.Dacă există, atunci tehnologia acestui producător este încă blocată în epoca mileniului.
Concentrația ionilor de magneziu:Concentrația ionilor de magneziu este foarte importantă în reacția PCR.Concentrația adecvată a ionilor de magneziu poate promova eliberarea activității enzimei Taq.Dacă concentrația este prea mică, activitatea enzimatică va fi redusă semnificativ;dacă concentrația este prea mare, amplificarea nespecifică catalizată de enzime va fi îmbunătățită.Concentrația ionilor de magneziu va afecta, de asemenea, recoacerea primerilor, temperatura de topire a șablonului și a produselor PCR, afectând astfel randamentul fragmentelor amplificate.Concentrația ionilor de magneziu este în general controlată la 25 mM.Desigur, pentru un kit bun, concentrația ionilor de magneziu trebuie bine controlată.Unii comercianți adaugă un agent de chelare a ionilor de magneziu la reactiv, care poate obține efectul de ajustare automată a concentrației ionilor de magneziu.
Concentrația de colorant fluorescent:Colorantul fluorescent, care este verdele SYBR pe care îl folosim de obicei, generează în principal fluorescență prin legarea de canelura minoră a ADN-ului dublu catenar, deoarece legarea colorantului de ADN-ul dublu catenar este nespecifică, adică atâta timp cât ADN-ul dublu catenar este combinat cu acesta, poate apărea fluorescența, astfel încât primer-dimerii se vor combina pentru a forma un semnal de fundal cu ADN-ul în sistem.
PS: Datorită proprietăților sale sensibile la lumină, produsele de pe piață sunt în general ambalate în tuburi de centrifugă opace maro (așa cum se arată în imaginea de mai jos).Cu toate acestea, acest lucru va întâmpina o problemă.Este dificil de observat dacă lichidul este aspirat la prelevare.În acest sens, Qingke este într-adevăr cel mai ușor de utilizat (așa cum se arată în imaginea de mai jos), iar tubul transparent este ambalat într-o pungă de tablă opaca.Apoi puneți-l într-o pungă de tablă, ținând cont de comoditatea de a evita lumina și prelevarea de probe.Trebuie să alegeți numărul corect de produs.TSE204 este o existență super rentabilă, ceea ce mă face să vreau să plantez iarbă.
Concentrația de colorant fluorescent este, de asemenea, foarte importantă.Dacă concentrația este prea mică, curba de amplificare nu va urca în etapa ulterioară și nu este perfectă;dacă concentrația este prea mare, va cauza interferențe de zgomot.Deoarece PCR cantitativ fluorescent depinde în principal de valoarea CT, dacă concentrația de colorant fluorescent nu este ajustată corespunzător, punctul scăzut este mai bun decât punctul înalt.Desigur, concentrația adecvată de colorant este cea mai bună.
ROX: Coloranții ROX sunt utilizați pentru a corecta erorile semnalului de fluorescență din pui la godeu.Unii producători de instrumente necesită calibrare, în timp ce alții nu.De exemplu, utilizarea instrumentului de amplificare PCR în timp real de la Thermo Fisher Scientific necesită de obicei calibrare, inclusiv 7300, 7500, 7500Fast, StepOnePlus etc. Instrucțiunile generale ale kit-ului îl vor descrie.
qPCR Mix de la Foregene conține, de asemenea, colorant ROX, care este convenabil pentru utilizare în diferite modele.
Tratament slab legat de hidrogen: Tratamentul legăturilor slabe de hidrogen este o chestiune relativ tehnică.Nimic nu a citit manualele multor truse, dar niciunul nu a menționat acest subiect.De fapt, este atât de important.Combinația de baze depinde în principal de rezistența legăturilor de hidrogen.Legăturile puternice de hidrogen sunt o amplificare normală, iar legăturile slabe de hidrogen duc la o amplificare nespecifică.Dacă legăturile slabe de hidrogen nu pot fi eliminate bine, amplificarea nespecifică nu poate fi evitată.În sfera autorului, doar câteva companii au observat această problemă.Cand achizitionezi kitul, te poti referi daca ai luat in considerare o solutie in acest sens pentru trusa pe care vrei sa o alegi.
Volumul de reacție: Sistemul 20-50ul este mai des folosit, iar volumele mai mici sunt susceptibile de a provoca erori.În general, instrucțiunile kit-ului vor recomanda utilizarea volumelor de reacție PCR.Nu fi inteligent și folosește volume mai mici pentru a economisi costuri.scopul de.Volumul recomandat de comercianți a fost efectiv testat și este posibil ca aceștia să nu rezolve problema erorilor cauzate de volumele mici.
2. Producătorul și numărul articolului plăcii tubulare
Toată lumea cunoaște principiul PCR cantitativ fluorescent.Colectarea fluorescenței se realizează în principal prin capace de tuburi PCR.Atunci când alegeți consumabile PCR, acordați atenție două puncte: transmisie bună a luminii și potrivite pentru instrument.În general, plăcile și tuburile mărcilor mainstream sunt în regulă, dar trebuie să alegi cu grijă în ceea ce privește adaptarea, altfel nu vei putea folosi instrumentul.
4. Cunoștințe de nivel superior
MIQE (8)—validare qPCR
Aceasta este prioritatea principală a qPCR!Atâția eroi au căzut în nisip aici.Desigur, este și posibil să fii norocos și genele pe care le-ai studiat să fie simple, așa că ai plutit prin peștera de gheață de-a lungul vântului.Informațiile de verificare ale qPCR au scopul de a testa fiabilitatea datelor.Enumerăm informațiile necesare de verificare după cum urmează:
1.Test de specificitate
Specificitatea amplificării genei țintă este testată prin verificarea dacă imaginea de electroforeză este o singură bandă;verificarea succesiunii;curba de topire pentru a vedea dacă harta vârfurilor este unică;verificarea digestiei enzimatice și alte metode.
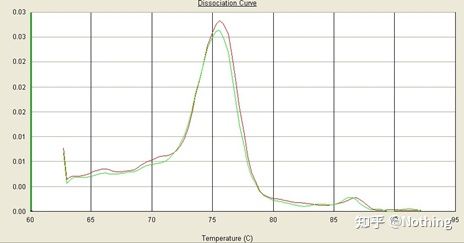
Aici, ne concentrăm pe tel analiza amplificării nespecifice folosind metoda curbelor de topire.În general, atunci când proiectăm primeri, dimensiunea fragmentului de produs trebuie să fie în intervalul 80-200bp, ceea ce face ca temperatura de topire a produsului PCR să fie în intervalul 80-85 °C.Prin urmare, dacă există vârfuri diverse, trebuie să existe și alți produse de amplificare nespecifice;dacă vârful apare sub 80°C, în general este considerat a fi un dimer de amorsare;dacă vârful apare peste 85°C, se consideră, în general, contaminare cu ADN sau mai mult Amplificare nespecifică a fragmentelor mari.
Notă: Uneori există doar un singur vârf la 80°C.În acest moment, acest concept trebuie respectat.Este probabil ca rezultatele amplificării să fie toți dimeri de primer.
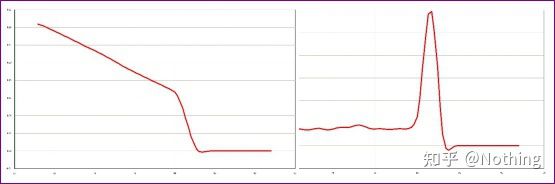
Curbă normală de topire (pic unic fără amplificare nespecifică)
Curba de topire problematica (amplificare nespecifica a varfurilor parasite)
【Analiza de caz】
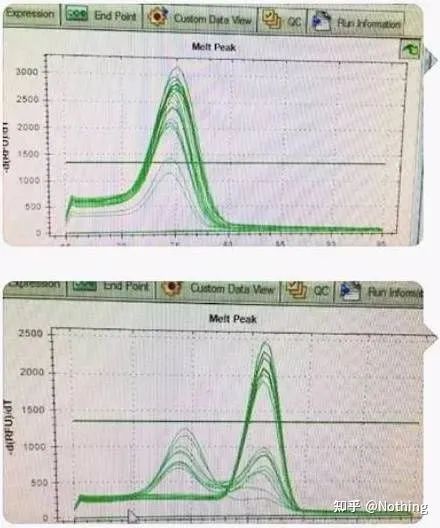
Există un vârf principal, dar dimerul de primer este grav
Curba de topire cu un singur vârf din figura de mai jos vă poate înșela cu ușurință ochii, crezând că este un experiment perfect, dar rezultatul este complet greșit.În acest moment, trebuie să ne uităm la temperatura de topire.Temperatura de vârf este sub 80°C, care este complet primer-dimer.
Niciun fragment țintă, toți dimerii de primer
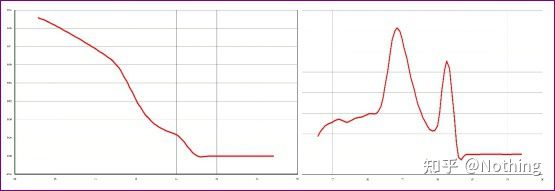
Aici, fratele meu nu se poate opri.Poza de mai jos este o fotografie făcută cu un telefon mobil trimis mie de un ticălos.Reactivii pe care i-a folosit sunt toți mărci utilizate în mod obișnuit în industrie.S-a schimbat de la o marcă de prefix T la o altă marcă de prefix T.Cred că ai ghicit deja.Nenorocitul mi-a strigat: „Reactivul folosit în prima poză este prea bun, iar vârful este unic.Ulterior, după ce ai folosit reactivul pe care l-ai recomandat, devine ca a doua poză, cu vârfuri mixte.M-ai făcut nenorocit.„
Separați cele două grafice.La prima vedere, unul are un singur vârf, iar celălalt are un vârf dublu.Prostii, un singur vârf e bine desigur.E adevarat?
Mai rău decât Dou E, dacă pun cele două poze din poza de mai jos, veți înțelege imediat.De fapt, suntem ușor paralizați de acest tip de imagine.După o analiză atentă, am constatat că: vârful primei figuri este la 75°C, care este complet dimer primer;vârful celei de-a doua cifre apare la 75°C și 82°C, cel puțin există Produsul apare.
Imagini cu feedback de la elevi
Deci problema fundamentală nu este problema reactivilor, ci problema designului primerului.Totodata, demonstreaza si ca unele marci mari nu sunt de calitate fier, si demonstreaza si ceea ce a spus fratele meu inainte: Nu marca de reactiv sustine articolul tau.Este articolul tău care a susținut marca de reactivi.Imaginați-vă doar, dacă ticălosul nu ar schimba reactivii, datele greșite ar fi trimise în jurnal, iar ceea ce s-ar întâmpla ar fi o tragedie.
2. Valoarea Ct a controlului gol
Nu explica, dacă controlul gol are o valoare Ct, nu este poluare?Cu toate acestea, trebuie să înțelegeți ce control gol are o valoare Ct.Dacă este NTC, înseamnă că există ADN străin, cum ar fi contaminarea cu reactiv.Dacă este NRT, înseamnă că ARN-ul extras are contaminare cu ADN.
3. Curba standard
Inclusiv panta și formula de calcul, eficiența PCR poate fi calculată prin formula.Un experiment perfect necesită ca panta curbei standard să se apropie de 3,32 și R² să se apropie de 0,9999.
4. Interval dinamic liniar
Domeniul dinamic al reacției este liniar.Conform șablonului utilizat pentru generarea curbei standard, intervalul dinamic trebuie să includă cel puțin 5 gradienți de concentrație și să acorde atenție modificării valorilor Ct la gradienți de concentrație mari și gradienți de concentrație scăzut.
5. Precizia detectării
Modificările rezultatelor qPCR, adică repetabilitate slabă, adică precizie slabă, sunt cauzate de mulți factori, inclusiv temperatura, concentrația și funcționarea.Precizia qPCR devine în general mai puțin controlabilă pe măsură ce numărul de copii scade.În mod ideal, în cadrul variației experimentale, această variație tehnică ar trebui să fie distinctă de variația biologică, iar replicile biologice pot aborda direct diferențele statistice în rezultatele qPCR între grupuri sau tratamente.În special pentru testele de diagnostic, trebuie raportată cea mai bună precizie inter-test (repetabilitate) între locații și operatori.
6. Eficiența detectării și LOD (în qPCR multiplex)
LOD este cea mai mică concentrație de 95% din probele pozitive detectate.Cu alte cuvinte, concentrația de LOD conținută într-un set de replici ale genei țintă nu trebuie să depășească 5% din reacțiile eșuate.Când se efectuează analize multiplex qPCR, în special pentru detectarea simultană a mutațiilor punctuale sau a polimorfismelor, qPCR multiplex trebuie să furnizeze dovezi că acuratețea fragmentelor țintă multiple nu este compromisă în același tub, detectarea multiplă și detectarea cu un singur tub Eficiența și LOD ar trebui să fie aceleași.În special atunci când genele țintă cu concentrație mare și genele țintă cu concentrație scăzută sunt amplificate simultan, trebuie să se acorde atenție acestei probleme.
Probleme și soluțiiÎn general, problemele întâlnite adesea în depanarea qPCR se concentrează pe următoarele aspecte:
·amplificare nespecifică
· Alegerea dificilă a concentrației primerului și probleme cu primer-dimeri
·Temperatura de recoacere este inexactă
·Structura secundară afectează eficiența de amplificare
amplificare nespecifică
amplificare nespecificăapare , se ia în considerare în general dacă designul grundului nu este potrivit, dar dacă nu vă grăbiți să schimbați grundurile, puteți încerca mai întâi următoarele metode (principiul este de asemenea atașat):
·Măriți temperatura de recoacere – încercați să faceți legături slabe de hidrogen care nu se pot menține;
·Scurtați timpul de recoacere și alungire – reduceți șansa de legături slabe de hidrogen;
·Reduce concentrația primerului – reduce șansa de legare a primerilor redundanți și a regiunilor nețintă;
Eficiență scăzută de amplificare
Situația opusă amplificării nespecifice – eficiență scăzută de amplificare, iar măsurile pentru a face față eficienței scăzute de amplificare sunt exact opusul:
·Prelungirea timpului de recoacere si alungire;
· Treceți la PCR în trei etape și reduceți temperatura de recoacere;
·Măriți concentrația primerului;
Ps: Mulți studenți absolvenți născuți în anii 90 nu sunt dispuși să studieze cum să depaneze experimentele și speră că kitul poate rezolva complet problema (dacă doriți să mergeți la o companie de reactivi pentru a face cercetare și dezvoltare după absolvire), de fapt, producătorii de reactivi cred și ei în acest fel, sper că este o prostie. factori de absorbție a legăturii.Pentru a rezolva cu ușurință problema, proștii mai trebuie să citească introducerea companiei de reactiv pentru a vedea dacă există un factor care absoarbe legăturile slabe de hidrogen.
Alegerea dificilă a concentrației primerului și probleme cu primer-dimeri
Metoda 1: În general, instrucțiunile trusei pentru qPCR au sisteme recomandate și concentrații recomandate de primer.
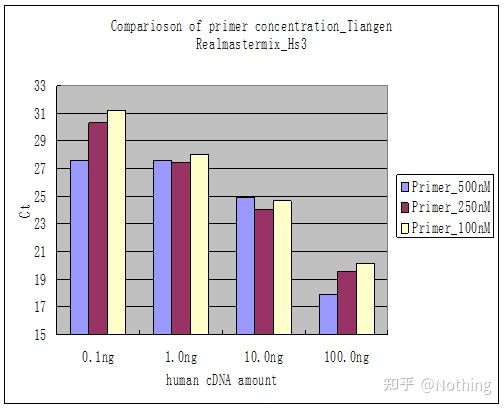
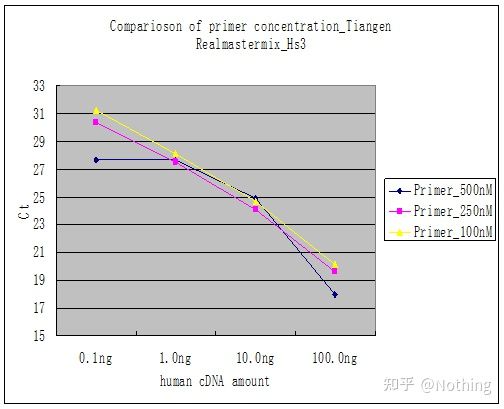
Metoda 2: Depanare prin setarea gradientului de concentrație a primerului.Poza de mai jos este furată de la o companie pentru a ilustra.Figura de mai jos prezintă rezultatele cantitative de fluorescență realizate cu trei gradienți de concentrație a primerului (100nM, 250nM, 500nM) și patru gradienți de concentrație șablon (0,1ng, 1ng, 10ng, 100ng).Valoarea Ct a rezultatelor experimentale este reprezentată după cum urmează:
Selectarea concentrației primerului Concatenați fiecare concentrație de primer într-o linie, după cum urmează:
Alegerea concentrației de primer este evidentă, relația liniară a concentrației de primer de 100 nM și 250 nM este mai bună, iar relația liniară a concentrației de primer de 500 nM este relativ slabă.În 100 nM și 250 nM, valoarea Ct de 250 nM este relativ mică, deci concentrația optimă a primerului este de 250 nM.În general, dimeri de grund sever pot fi observați în curba de topire.Ce se întâmplă dacă primerii proiectați nu pot evita grundurii-dimeri?
Metoda 3: Reduceți cantitatea de grunduri și creșteți temperatura de recoacere (nu este nevoie să explicați).
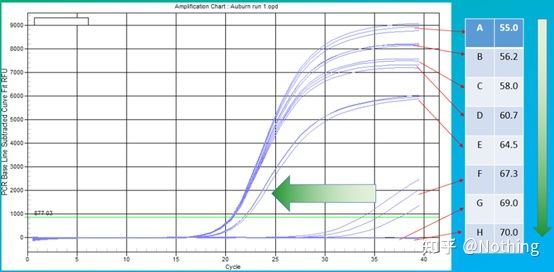
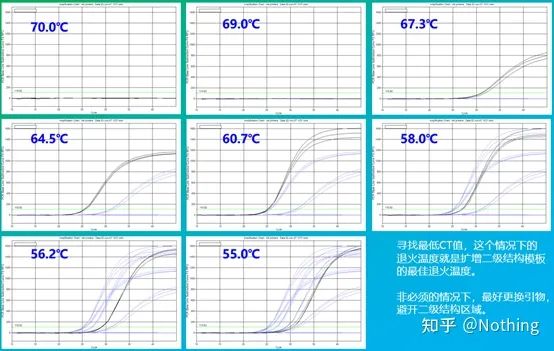
Valoarea empirică a temperaturii de recoacere este de 60°C.Dacă nu sunteți sigur, cum să selectați o temperatură de recoacere mai potrivită?Răspunsul este același cu alegerea concentrației primerului -test de gradient.Faceți o poză de la compania Bio-rad pentru a ilustra problema.Pentru amplificarea unui anumit fragment țintă, setați opt gradienți de temperatură, fiecare cu trei repetări, iar curba de amplificare obținută este următoarea:
selectarea temperaturii de recoacere:
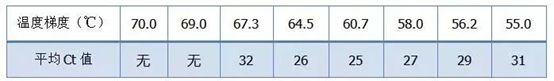
·70°C, 69°C — Practic, primerii nu pot fi combinați, deci nu există amplificare.
·67,3°C – Există o cantitate mică de amplificare la început, iar valoarea Ct este relativ mare.
·64,5°C——Valoarea Ct scade.
·La 60,7°C, 58,0°C, 56,2°C și 55,0°C, valorile Ct au avut tendința de a fi practic stabile, dar valorile finale ale fluorescenței au fost diferite.
Cum să alegi?Principiu: Primul principiu este valoarea Ct mai mare.Pentru aceeași valoare Ct, alegeți o temperatură de recoacere mai mare pentru a evita dimerizarea și amplificarea nespecifică.Deși există o valoare mai mare a fluorescenței la 55°C, pot exista dimeri sau amplificare nespecifică în ea.
Dar dacă ești la fel de deștept ca tine, cu siguranță te vei gândi: logic vorbind, dacă reacția PCR este foarte specifică, atâta timp cât concentrația primerului depășește cerința minimă, punctele înalte și scăzute nu ar trebui să aibă efect, la fel ca coloranții fluorescenți și dNTP-urile.Într-adevăr, atâta timp cât temperatura de recoacere este optimizată corespunzător, efectul concentrației primerului asupra valorii Ct va fi în mod natural minimizat.
Temperatura de recoacere este optimizată corespunzător, iar efectul concentrației primerului asupra CT va fi minimizat
Structura secundară afectează eficiența de amplificare
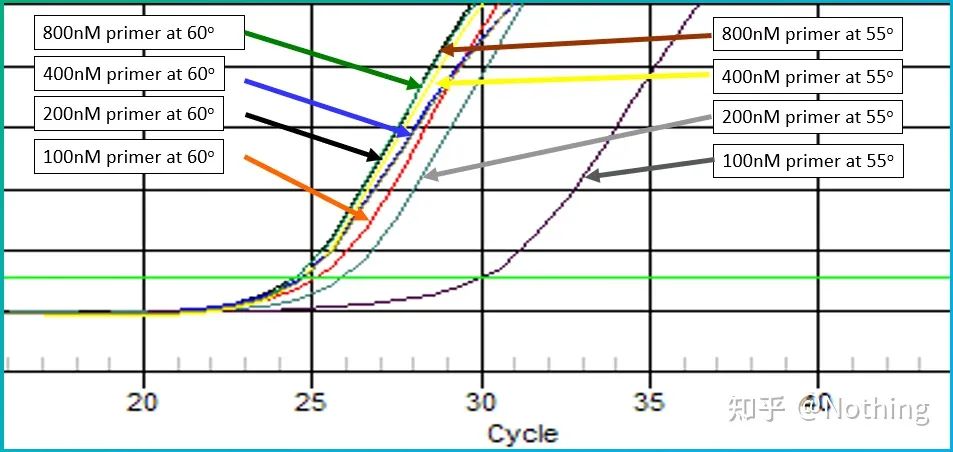
Să luăm poza din Bio-rad pentru a ilustra problema.De asemenea, proiectează un gradient de temperatură pentru a amplifica o genă cu o structură secundară.
Apare structura secundară
Se poate observa că pe măsură ce gradientul de temperatură scade, încep să apară produse și valoarea Ct se deplasează înainte, atingând valoarea minimă la 60,7°C, iar apoi pe măsură ce gradientul de temperatură scade, valoarea Ct devine mai mare.În schimb, pe măsură ce temperatura crește, structura secundară se deschide și eficiența de amplificare crește.După atingerea unei anumite temperaturi, creșterea temperaturii nu poate îmbunătăți eficiența amplificării.Deoarece amorsele nu pot fi combinate stabil în acest moment.Prin urmare,căutați temperatura cu cea mai mică valoare Ct, care este cea mai bună temperatură pentru amplificarea șablonului de structură secundară!Desigur, proștii deștepți trebuie să știe că, dacă nu este necesar, cel mai bine este să schimbați grundule și să evitați regiunea structurii secundare.
5. Nivel de aplicare
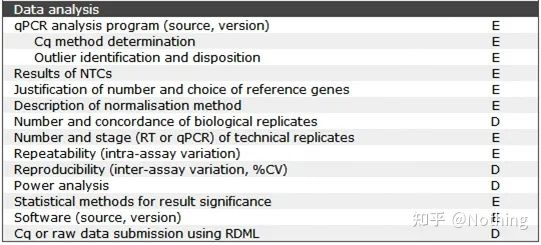
MIQE - Analiza datelor
Analiza datelor este dată în principal de instrumentul PCR cantitativ fluorescent.În articolul anterior, s-au efectuat o mulțime de lucrări de analiză a datelor, cum ar fi controlul gol, care a fost explicat în proiectarea experimentului.Au fost clarificate genele de referință interne, numerele repetate etc., aici explicăm în principal aplicarea qPCR.
qPCR este utilizat pe scară largă, iar verificarea experimentală și diagnosticarea acidului nucleic sunt scenariile cele mai frecvent utilizate.
cuantificare absolută
Log (concentrația inițială) are o relație liniară cu numărul de cicluri.O curbă standard poate fi trasă dintr-un standard cu număr inițial de copie cunoscut, adică se poate obține relația liniară a reacției de amplificare.În funcție de valoarea Ct a probei, concentrația din eșantion poate fi calculată.Cantitatea de șabloane de inclus.
Metoda de calcul cantitativ absolut
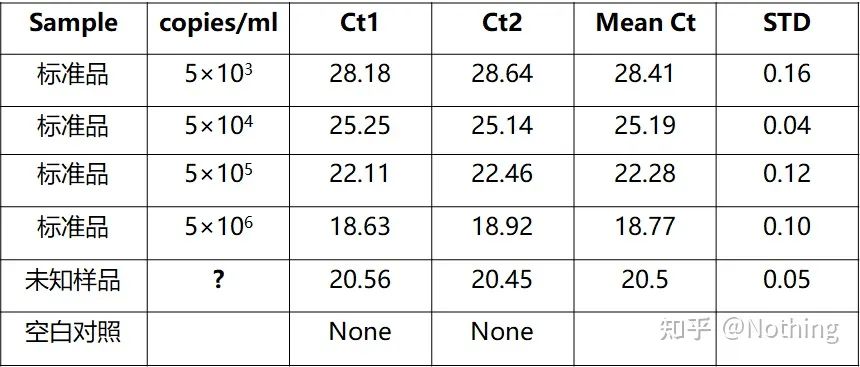
Cuantificarea absolută trebuie să se bazeze pe curba standard.Pentru a face o curbă standard, este necesar un standard.De obicei, standardul este o plasmidă obținută prin donarea genei țintă.De ce este o plasmidă?Deoarece ADN-ul plasmid circular este cel mai stabil.Diluați produsul standard în 5 până la 6 gradienți în funcție de raportul de dublare (diluție de 10 ori) și acordați atenție uniformității la diluare.Lăsați valoarea Ct să scadă între 15-30.
Preparare standard
În același timp, proba de testat trebuie și ea diluată corespunzător (rețineți factorul de diluție), iar valoarea Ct ar trebui să scadă și ea între 15-30.Produsul standard + proba de testat sunt puse împreună pe mașină.După rulare, s-a făcut o curbă standard cu substanța standard, iar probele de testat au fost aduse în curba standard pentru a calcula concentrația.
Cuantificarea virusului hepatitei B HBV este o cuantificare absolută tipică, care poate calcula numărul de copii ale virusului în 1 ml de sânge.
Calculul numărului de exemplare
Concentrația probei de testat (ng/ul) = OD260 × 50ug/ml × factor de diluție
Greutatea moleculară a probei = numărul de baze × 324
Numărul de exemplare al probei de testat (copii/ul) = concentrația probei de testat / greutatea moleculară a probei × 6 × 1014
Metoda de calcul al numărului de exemplare
Cele de mai sus este metoda de calcul pentru determinarea cantității.Aceasta este o problemă de matematică care poate fi rezolvată după absolvirea liceului, iar problemele de matematică sunt rezolvate în general de computere.Dacă nu înțelegi, poți veni să comunici.
cuantificare relativă
Cuantificarea relativă este utilizată în principal în cercetarea științifică.Câți viruși sunt în 1 ml de sânge și este un virus ADN, acesta este un eveniment relativ determinist: cantitatea de sânge poate fi determinată, iar virusul ADN este relativ stabil.Cu toate acestea, este dificil pentru noi să comparăm numărul de copii de transcripție ale unei anumite gene dintr-o frunză, deoarece este dificil de determinat dimensiunea, greutatea și sensibilitatea frunzei, cantitatea de ARN extras este dificil de determinat și eficiența transcripției inverse este, de asemenea, dificil de determinat, adică orice pas poate face ca datele experimentale să aibă erori și să nu poată fi utilizate.
Prin urmare, cuantificarea relativă trebuie să introducă un element:gena de referință internă.
Cu alte cuvinte, cuantificarea relativă este de fapt o comparație între gena țintă și gena de referință internă.În comparație cu același țesut și aceeași celulă, influența dimensiunii probei, a cantității de extracție a ARN, a eficienței transcripției inverse și a eficienței PCR este relativ mică.Din cauza dimensiunii mici a eșantionului, atât genele de referință interne, cât și genele țintă au fost relativ reduse.Acesta este motivul pentru care am mai pus accentul pe uniformitate și stabilitate.
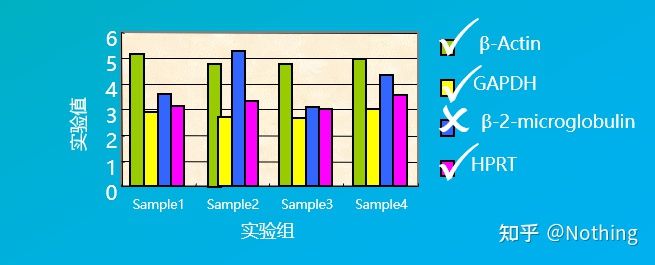
Genele de referință interne sunt în generalgenele de menaj(gene de întreținere), care se referă la o clasă de gene care sunt exprimate stabil în toate celulele, iar produsele lor sunt necesare pentru a menține activitățile de viață de bază ale celulelor.
Nu confunda acest concept.Genele menajere sunt termeni de funcție biologică, în timp ce genele de referință interne sunt termeni tehnici experimentali.Genele menajere trebuie să treacă validarea înainte de a putea fi selectate ca gene de referință interne.
De exemplu, am selectat mai multe gene de menaj în figura de mai jos pentru a testa nivelurile lor de expresie în diferite celule ale țesutului și am constatat că nivelurile de expresie ale β-2-microglobulinei erau destul de diferite de cele ale celorlalte trei gene, așa că nu au putut fi folosite ca gene de referință interne.
După înțelegerea funcției de corecție a genei de referință interne, sunt derivați doi algoritmi datorită introducerii genei de referință interne.
·metoda curbei standard dublu
·2 – △△Metoda Ct (metoda de comparare a valorii CT)
Dacă sunteți interesat să studiați speciile și funcțiile genelor, vă rugăm să renunțați la cercetarea pe algoritmi și să folosiți formule direct, sau să folosiți direct mașini;dacă sunteți un tip heterosexual în matematică și inginerie, vă rugăm să nu ezitați.
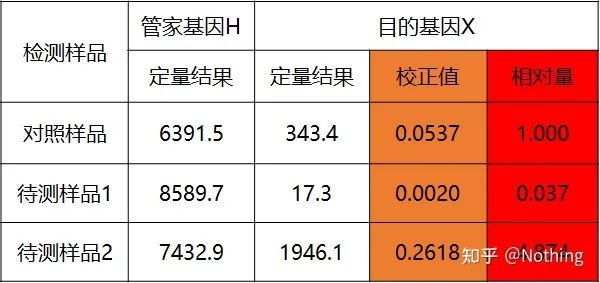
metoda curbei standard duble
Cuantificați gena țintă și gena de întreținere a probei de control și a probei de testat prin curba standard și apoi calculați valoarea relativă conform formulei de calcul, care este nivelul de expresie relativ.
Avantaje: analiză simplă, optimizare experimentală relativ simplă
Dezavantaj: Pentru fiecare genă, fiecare rundă de experimente trebuie să facă o curbă standard
Aplicație: Una dintre cele două metode cantitative relative cele mai frecvent utilizate și recunoscute în studiul reglării expresiei genelor
Formula este următoarea:
Exemplele sunt următoarele:
Calculați suma relativă pe baza rezultatului cantitativ
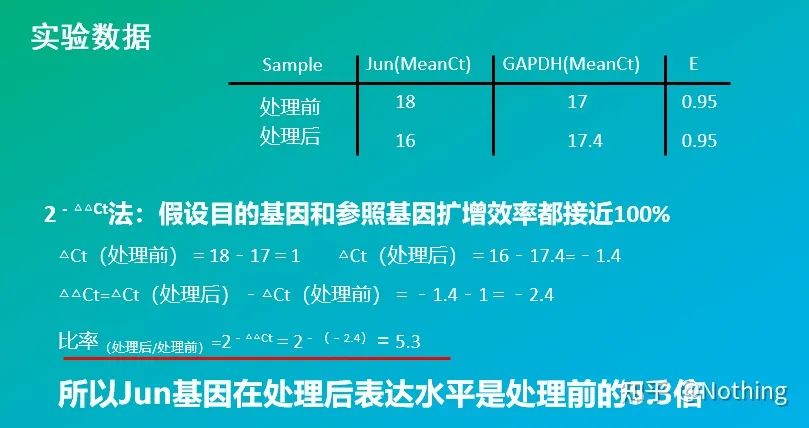
2 – Metoda △△Ct (metoda de comparare a valorii CT)
Avantaje: Nu este nevoie să faceți o curbă standard
Dezavantaje: Se presupune că randamentul de amplificare este aproape de 100%;abaterea standard este < 5%, iar curba standard și eficiența dintre fiecare amplificare sunt considerate a fi consistente;optimizarea condiţiilor experimentale este mai complicată.
Aplicație: Una dintre cele două metode cantitative relative cele mai frecvent utilizate și recunoscute în studiul reglării expresiei genelor
Desigur, eficiența de amplificare este de obicei imposibil să fie perfect 1. Metoda de corecție: Dacă știm că gena țintă și gena de referință au aceeași eficiență de amplificare, dar eficiența de amplificare nu este egală cu 1, atunci 2-△△Ct poate fi corectat astfel: (1+E )-△△Ct, de exemplu, calculul poate fi corectat, dacă eficiența de amplificare poate fi corectată, de exemplu, 95 de amplificare. 1,95-△△Ct
Până acum, conținutul despre PCR cantitativ fluorescent a ajuns la sfârșit.
Ora postării: Apr-06-2023